
题目列表(包括答案和解析)
 |
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -① | |||
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
| c(v2-v1)106 |
| 1000w |
| c(v2-v1)106 |
| 1000w |
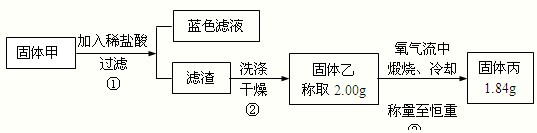
 (2011?武汉模拟)某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(2011?武汉模拟)某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:| 实验序号 | KClO3质量 | 其它物质质量 | 待测数据 |
| ④ | 1.2g | 无其他物质 | |
| ⑤ | 1.2g | CuO 0.5g | |
| ⑥ | 1.2g | MnO2 0.5g |
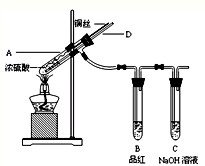 某实验小组同学为了探究铜与浓硫酸的反应,进行如下实验.
某实验小组同学为了探究铜与浓硫酸的反应,进行如下实验.
| ||
| ||
| ||
| ||
过二硫酸钾(K2S2O8)是一种无色结晶,不溶于乙醇,有强氧化性,易分解。实验室制备过二硫酸钾可通过低温电解KHSO4认溶液得到。
实验步骤如下:
步骤1.称取40gKHSO4溶解90mL蒸馏水,倒入大试管,试管浸在冰水浴中(装置见图9),并冷却到5℃以下。

步骤2电解2h,每隔约半小时补一次冰
步骤3.将沉淀收集在漏斗中,直接用乙醇和乙醚洗涤和过滤
步骤4.干燥、称重
步骤5.回收乙醚和乙醇
(1)电解总反应的化学方程式为 。
(2)电解过程中,阳极产生微量且能使湿润的KI-淀粉变蓝的有色单质气体,该气体可能是(填化学式)。
(3)步骤2每隔半小时要向大烧杯添加冰块,其原因是 。
(4)步骤5回收乙醇、乙醚时采用的操作方法是 。
(5)取得到的样品0.2500g溶于30mL水,加4gKI,塞住瓶塞,振荡,静止15min,加入1mL冰醋酸,再用cmol·L- 1Na2S2O3溶液滴定。(S2O82- +3I- =2SO42-
+I3-;I3- I2+I-;2S2O32-+I2=2I- +
S4O62-)
I2+I-;2S2O32-+I2=2I- +
S4O62-)
①溶解时,加入KI后需塞住瓶塞,其目的是 。
②本实验所用的指示剂为 。
③若本次滴定消耗Na2SO3溶液VmL,由本次结果计算,样品中K2S2O8的纯度为(用含c、V的代数式表示)。
(6)分析化学上检验Mn2+在Ag+催化下K2S2O8溶液将Mn2+氧化为紫色的MnO4-,该反应的离子方程式为 。
过二硫酸钾(K2S2O8)是一种无色结晶,不溶于乙醇,有强氧化性,易分解。实验室制备过二硫酸钾可通过低温电解KHSO4认溶液得到。
实验步骤如下:
步骤1.称取40gKHSO4溶解90mL蒸馏水,倒入大试管,试管浸在冰水浴中(装置见图9),并冷却到5℃以下。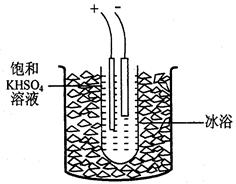
步骤2电解2h,每隔约半小时补一次冰
步骤3.将沉淀收集在漏斗中,直接用乙醇和乙醚洗涤和过滤
步骤4.干燥、称重
步骤5.回收乙醚和乙醇
(1)电解总反应的化学方程式为 。
(2)电解过程中,阳极产生微量且能使湿润的KI-淀粉变蓝的有色单质气体,该气体可能是(填化学式)。
(3)步骤2每隔半小时要向大烧杯添加冰块,其原因是 。
(4)步骤5回收乙醇、乙醚时采用的操作方法是 。
(5)取得到的样品0.2500g溶于30mL水,加4gKI,塞住瓶塞,振荡,静止15min,加入1mL冰醋酸,再用cmol·L- 1Na2S2O3溶液滴定。(S2O82- +3I- =2SO42- +I3-;I3- I2+I-;2S2O32-+I2=2I- + S4O62-)
I2+I-;2S2O32-+I2=2I- + S4O62-)
①溶解时,加入KI后需塞住瓶塞,其目的是 。
②本实验所用的指示剂为 。
③若本次滴定消耗Na2SO3溶液VmL,由本次结果计算,样品中K2S2O8的纯度为(用含c、V的代数式表示)。
(6)分析化学上检验Mn2+在Ag+催化下K2S2O8溶液将Mn2+氧化为紫色的MnO4-,该反应的离子方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com