
题目列表(包括答案和解析)
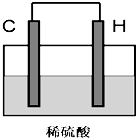 下表是元素周期表的前三周期:
下表是元素周期表的前三周期:| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 一 | A | |||||||
| 二 | B | C | D | E | F | |||
| 三 | G | H | I | J |
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||
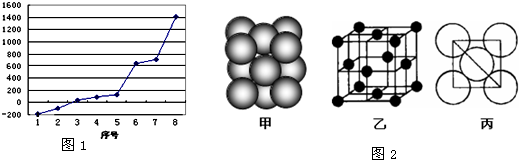


| ||
| 8NAd3 |
| ||
| 8NAd3 |
| A | B | ||||||
| D | E | F | G | ||||
| C | H | J | K |
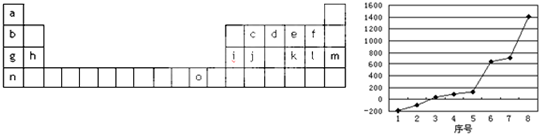
下表是元素周期表的一部分,回答有关问题
|
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 |
|
|
|
| a |
| b |
|
| 3 | c | d | e | f |
| g | h | i |
| 4 |
| k |
|
|
|
| l |
|
(1) 画出下列元素的轨道表示式:
a: d:
(2)写出下列元素原子的电子排布式:
k: l:
(3) 在这些元素中,第一电离能最小的元素是_____,电负性最大的元素是_____,最不活泼的元素是______;(填元素符号或化学式,下同)
(4) 在这些元素的最高价氧化物对应的水化物中,酸性最强的是_____,碱性最强的是_____,呈两性的氢氧化物是_____
(5) 在g与h元素中,非金属性较强的是_____,用一个化学方程式验证该结论:
(6)元素d和e的电离能如下:
| 电离能kJ/mol | I1 | I2 | I3 | I4 |
| d | 738 | 1450 | 7730 | 10550 |
| e | 577 | 1817 | 2745 | 11578 |
请解释元素d的I1比元素e的I1大的原因
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com