
题目列表(包括答案和解析)
| |||||||||||||||||||
乙炔是有机合成工业的一种原料,工业上曾用CaC2与水反应制备乙炔。
(1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为 ;1 mol O中含有的π键数目为 。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2,红棕色沉淀。Cu+基态核外电子排布式为 。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH—C≡N)。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
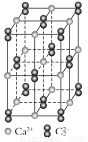
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如右图所示),但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长,CaC2晶体中1个Ca2+周围距离最近的C22-数目为 。
 N),丙烯腈分子中碳原子轨道杂化类型是________;分子中处于同一直线上的原子数目最多为__________。
N),丙烯腈分子中碳原子轨道杂化类型是________;分子中处于同一直线上的原子数目最多为__________。 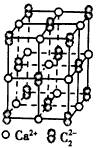

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com