
题目列表(包括答案和解析)
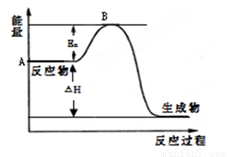
已知在101 kPa下,1 g氢气在氧气中完全燃烧生成气态水时,放出热量120.9 kJ.则下列说法中正确的是( )
A.氢气的燃烧热为241.8 kJ/mol
B.1 mol H2O(l)具有的能量大于1 mol H2O(g)具有的能量
C.反应的热化学方程式为:2H2(g)+O2(g)===2H2O(g);ΔH=+483.6 kJ/mol
D.2 mol H2(g)和1 mol O2(g)具有的能量总和大于2 mol H2O(g)具有的能量
(16分)(1)已知:①N2(g)+O2(g)=2NO(g); △H=+180.5 kJ·mol-1
②4NH3(g)+5O2(g)= 4NO(g)+6H2O(g);△H=-905 kJ·mol-1
③2H2(g)十O2(g)=2H2O(g):△H=-483.6 kJ·mol-1
则N2(g)+3H2(g)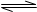 2NH3(g)的△H=
。
2NH3(g)的△H=
。
(2)在一定条件下,将2mol N2与5mol H2混合于一个10 L的密闭容器中,反应情况如图1所示:
①求5min内的平均反应速率v(NH3)= ;②达到平衡时NH3的体积分数为 。
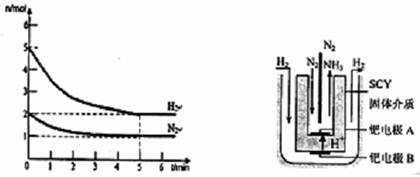
图1 图2 电解法合成氨装置
(3)近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A上发生的电极反应式是 。
(4)草酸(H2C2O4)是一种重要的化工原料。已知常温下0.01 mol·L-l的H2C2O4、KHC2O4、K2C2O4 溶液的pH如下表所示。
|
|
H2C2O4 |
KHC2O4 |
K2C2O4 |
|
pH |
2.0 |
3.1 |
8.1 |
①用离子方程式表示KHC2O4呈酸性的原因:
②取一定质量H2C2O4·2H2O和KHC2O4的混合物,加水溶解,配成250 mL溶液,取两份此溶液各25 mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25 mol·L-l NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3 mol·L-l H2SO4溶液酸化后,用0.10 mol·L-l KMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:
a.完成离子方程式: C2O42-+ MnO4-+ H+ = CO2+ Mn2++ H2O。
b. 原混合物中H2C2O4·2H2O和KHC2O4的物质的量之比为__________。
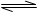 2NH3(g)的△H= 。
2NH3(g)的△H= 。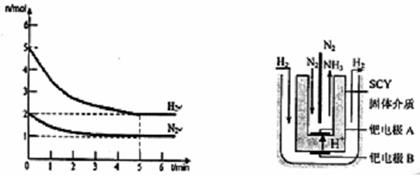
| | H2C2O4 | KHC2O4 | K2C2O4 |
| pH | 2.0 | 3.1 | 8.1 |
 CO(g)+H2(g) △H= +131.3kJ·mol-1
CO(g)+H2(g) △H= +131.3kJ·mol-1 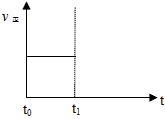

为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g) ΔH =-566 kJ·moL-1
2H2(g)+O2(g)=2H2O(g) ΔH =-483.6 kJ·moL-1
H2O(g)=H2O(l) ΔH =-44.0 kJ·moL-1
(1)氢气的标准燃烧热△H = kJ·moL-1。
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式: 。
(3)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com