
题目列表(包括答案和解析)

| ||
| ||
| ||
| ||
| ||
| ||

| ||
| ||
海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是 (填:物理变化或化学变化)。
(2)工业上利用电解饱和食盐水可制得重要化工产品。反应式为:食盐+H2O ?? NaOH+H2??+Cl2??(未配平),该反应中食盐的化学式是 ;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐 t。
(3)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下:
 请写出②④的化学反应方程式: 、 。
请写出②④的化学反应方程式: 、 。
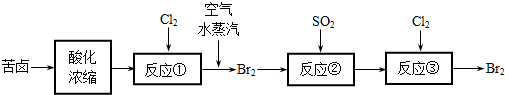
海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。

完成下列填空:
(1)氯碱工业主要以食盐为原料。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列操作,正确的操作顺序是 。
①过滤;②加过量的NaOH溶液;③加适量的盐酸;④加过量的Na2CO3溶液;⑤加过量的BaCl2溶液
a.②⑤④①③ b.①④②⑤③ c d.⑤②④①③
(2)在实验室中可以用萃取的方法提取溴,可选用的试剂是________________,所用主要仪器的名称是____________________。
(3)步骤Ⅰ中用硫酸酸化可提高Cl2利用率的原因是 。
(4)步骤II反应的离子方程式__________________________________________。
(5)海水提溴蒸馏过程中,温度应控制在80~90℃,温度过高或过低都不利于生产 ,请解释原因 。
(6)Mg(OH)2沉淀中混有Ca(OH)2,可选用__________溶液进行洗涤除去。如直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,你_______(选填“同意”,“不同意”)该说法,理由是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com