
题目列表(包括答案和解析)
氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术
叫哈伯法,是德国人哈伯1905年发明的,其合成原理为:N2(g) + 3H2(g) ![]() 2NH3(g),△H=-92.4 kJ/mol,△S = -198.3J·mol-1·K-1。他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g),△H=-92.4 kJ/mol,△S = -198.3J·mol-1·K-1。他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
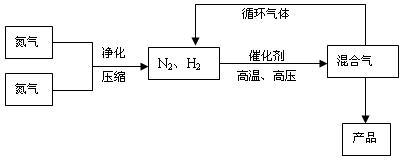
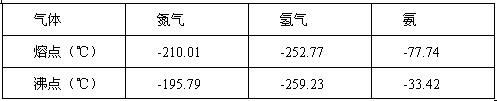
反应体系中各组分的部分性质见下表:
(1)下列说法正确的是
A. 因为△H= -92.4 kJ/mol,所以该反应一定能自发进行
B. 因为△S = -198.3J·mol-1·K-1所以该反应一定不能自发进行
C. 该反应在一定条件下可能自发进行。
(2)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 使混合气体分离出来产品;继续循环的气体是 。
(3)一定温度下,在密闭容器中充入1 mol N2和3 mol H2并发生反应。
①若容器容积恒定,达到平衡时,气体的压强为原来的7/8,则N2的转化率а1= ,此时反应放热 kJ;
②若容器压强恒定,则达到平衡时,容器中N2的转化率а2 а1(填“>、<或=”)。
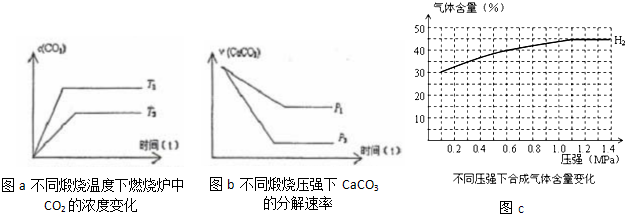
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)![]() 2NH3(g) 反应的影响。
2NH3(g) 反应的影响。
实验结果如图所示:(图中T表示温度,n表示物质的量)
① 图像中T2和T1的关系是:T2 T1,(填“高于”“低于”“等于”“无法确定”)
② 比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最高的是 (填字母)。
③ 在起始体系中加入N2的物质的量为n/3mol时,反应后氨的百分含量最大;若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K= 。(不用写单位)
| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: ①C(s)+H2O(g)=CO(g)+H2(g) △H=+131.6kJ?mol-1 ②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ?mol-1 ③CaO(s)+CO2(g)=CaCO3(s) △H=-178.3kJ?mol-1 |
通入纯氧,主要化学反应: ④C(s)+O2(g)=CO2(g) △H=-393.8kJ?mol-1 ⑤CaCO3(s)=CaO(s)+CO2(g) K |
最新选择题专项训练
2005年2月18日英国食品标准署就食用含有添加苏丹红色素的食品可能诱发癌症向消费者发出警告。我国也已开始追查含苏丹红色素的食品。所谓“苏丹红一号”实际上一般称为“苏丹一号”,是一种黄溶剂染料,按化学染料分类称为溶剂黄14(C.L.Solvent,Yellow14),分子式为C16H12N2O,其化学结构属偶氮类染料,是由苯胺重氮化后与2-萘酚偶合制得。有关苏丹红一号下列说法正确的是( )
A.苏丹红一号在食品中能起到增色的作用,可在辣椒酱中用作添加剂
B.苏丹红一号的摩尔质量为248
C.苏丹红一号可用于溶解剂、机油、蜡和鞋油等产品的染色
D.食品添加剂对人体危害较大,因此应全面禁止使用。
NA为阿佛加德罗常数,下述正确的是 ( )
A.80g硝酸铵含有氮原子数为2NA
B.1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA
C.标准状况下,11.2L四氯化碳所含分子数为0.5 NA
D.在铜与硫的反应中,1mol铜失去的电子数为2 NA
在pH =1的无色溶液中能大量共存的离子组是 ( )
A.NH4+、Mg2+、SO42-、Cl- B.Ba2+、K+、OH-、NO3-
C.Al3+、Cu2+、SO42-、Cl- D.Na+、Ca2+、Cl-、AlO2-
拟除虫菊酯是一类高效、低毒、对昆虫具有强
烈触杀作用的杀虫剂,其中对光稳定的溴氰
菊酯的结构简式如右图:
下列对该化合物叙述正确的是( )
A.属于芳香烃 B.属于卤代烃
C.在酸性条件下不水解 D.在一定条件下可以发生加成反应
可以将反应Zn+Br2=ZnBr2设计成蓄电池,下列4个反应 ①Br2+2e=2Br-②2Br—2e=Br2③Zn-2e=Zn2+④Zn2++2e=Zn其中表示充电时的阳极反应和放电时的负极反应的是
A ②和③ B ②和① C ③和① D ④和①
NaH是—种离子化合物,它跟水反应的方程式为:NaH+H2O→NaOH+H2↑,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气。下列有关NaH的叙述错误的是( )
A 跟水反应时,水作氧化剂 B NaH中H-半径比Li+半径小
C 跟液氨反应时,有NaNH2生成 D 跟乙醇反应时,NaH被氧化
右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )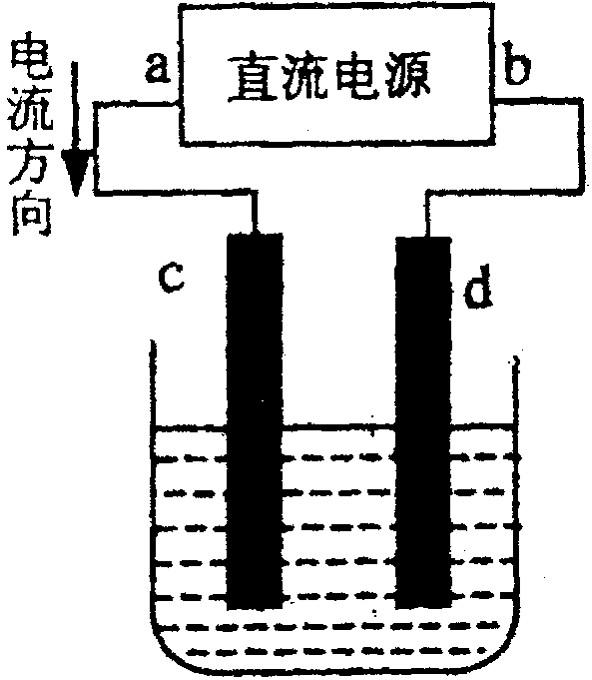
A a为负极、b为正极 B a为阳极、b为阴极
C 电解过程中,d电极质量增加
D 电解过程中,氯离子浓度不变
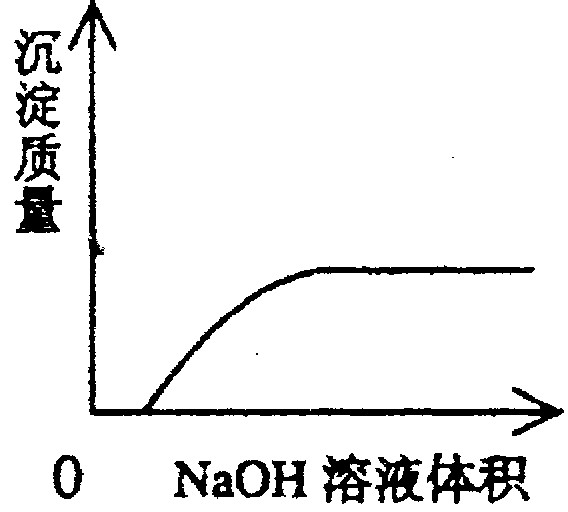
下列实验过程中产生的现象与对应的图形相符合的是
A NaHSO3粉末加入HNO3溶液中 B H2S气体通入氯水中
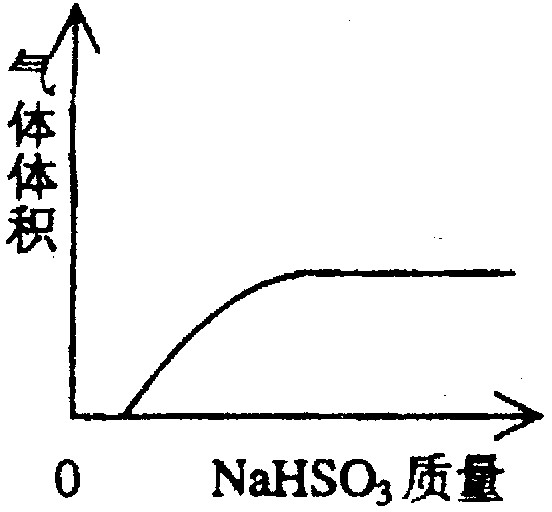
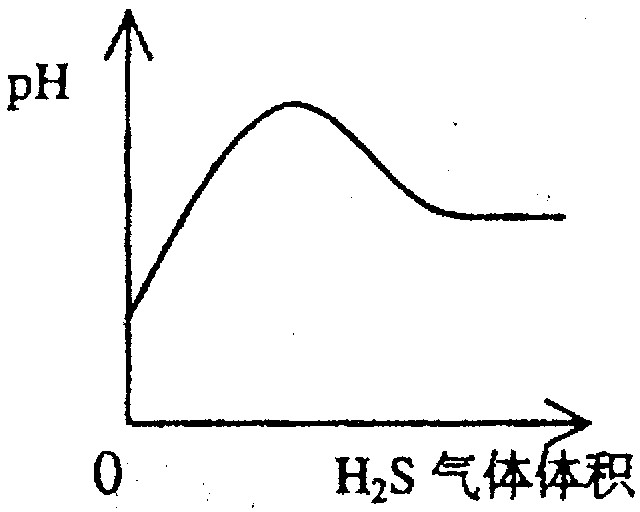
C NaOH溶液滴入Ba(HCO3)2溶液中 D CO2气体通入澄清石灰水中

是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为( )
A 1︰1 B 2︰1 C 1︰2 D 2︰3
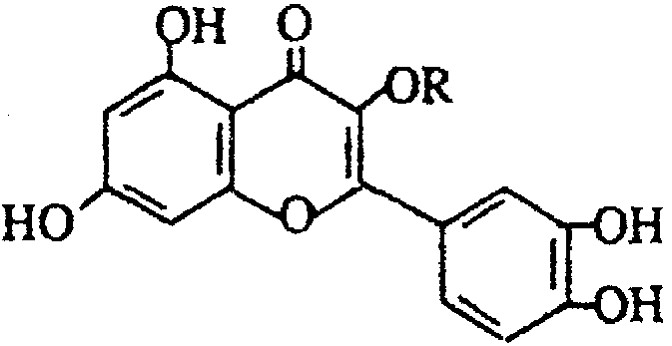
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是
A 可以和溴水反应 B 可用有机溶剂萃取
C 分子中有三个苯环 D 1mol维生素P可以和4molNaOH反应
下图中能验证氯化钠溶液(含酚酞)电解产物的装置是
A、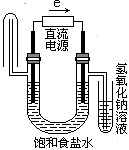 B、
B、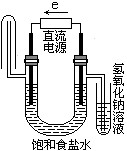
C、 D、
D、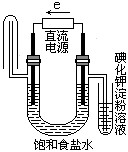
CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同。以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是
A、将两种样品分别溶于硝酸,区别所产生的气体
B、将两种样品分别溶于硝酸,区别溶液的颜色
C、取两种同质量的样品分别在高温中灼烧,区别残留固体的质量
D、取两种同质量的样品分别在高温中灼烧,区别残留固体的颜色
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 molCu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为( )
A、0.1 mol B、0.2 mol C、0.3 mol D、0.4 mol
下列各组气体或溶液用括号试剂加以鉴别,其中不合理的是
A、二氧化碳、二氧化硫、一氧化碳(品红溶液)B、酒精、醋酸、醋酸钠(石蕊试液
C、氯化钠、硝酸银、碳酸钠(稀盐酸) D、硫酸、硝酸钡、氯化钾(碳酸钠溶液)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com