
题目列表(包括答案和解析)
X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
 W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2
W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2 17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1 HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。
17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1 HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。 A、B、C、D、E、F是元素周期表前四周期的六种元素,原子序数依次增大,其相关信息如下表:
元素 相关信息
A 原子的核外电子数和电子层数相等
B 基态原子价电子排布为nsnnpn
C 气态氢化物与最高价氧化物的水化物反应生成盐
D 基态原子电子排布有2个未成对电子
E 位于第三周期,在同周期中原子半径最大
F 与B 形成的合金为目前用量最多的金属材料
(1)C位于元素周期表第 周期第 族。F元素基态原子的核外电子排布式是 。
(2)六种元素中,电负性最大的元素是 (填元素符号),D的一种核素原子核内有10个中子,该核素的符号是 。
(3)E2D2的电子式是 ,BD2的晶体类型为 。化合物丙由D、F两种元素组成,丙可作油漆的一种颜料,化合物丁由B、D两种元素组成。工业上由丙和丁在高温下反应生产F的单质,写出该反应的化学方程式: 。
(4)在2L密闭容器中加入3molA2和一定量C2发生反应:3A2+C2 2CA3
△H<0,反应10min达到平衡,生成0.2molCA3。
2CA3
△H<0,反应10min达到平衡,生成0.2molCA3。
①该反应平衡常数表达式为(各物质均写化学式)K=
②从起始到平衡,以C2浓度变化表示的平均反应速率为
A、B、C、D、E、F是元素周期表前四周期的六种元素,原子序数依次增大,其相关信息如下表:
| 元素 | 相关信息 |
| A | 原子的核外电子数和电子层数相等 |
| B | 基态原子价电子排布为nsnnpn |
| C | 气态氢化物与最高价氧化物的水化物反应生成盐 |
| D | 基态原子电子排布有2个未成对电子 |
| E | 位于第三周期,在同周期中原子半径最大 |
| F | 与B 形成的合金为目前用量最多的金属材料 |
 2CA3△H<0,反应10min达到平衡,生成0.2molCA3。
2CA3△H<0,反应10min达到平衡,生成0.2molCA3。A、B、C、D为原子序数依次增大的前四周期元素,元素A原子最外层电子数比内层多3个,元素B基态原子核外有2个未成对电子,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB族。
⑴判断离子AB2-离子的空间构型为 。
⑵元素A、C形成的化合物熔点很高,但比B、C形成的化合物熔点低,其原因是 。
⑶在A的氢化物(A2H4)分子中,A原子轨道的杂化类型是 。
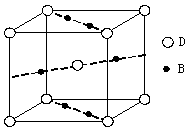
⑷元素B与D形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。
该化合物的化学式为 。
⑸向D的氯化物DCl3溶液中滴加氨水可形成配合物[D(NH3)3(H2O)Cl2]Cl。
①离子D3+的外围电子排布式为 。
②1 mol该配合物中含配位键的数目为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com