
题目列表(包括答案和解析)
| A、该塑料的生产和使用可减少温室效应 | B、该塑料的使用可减少对臭氧层的破坏 | C、可以充分利用廉价的资源生产塑料 | D、该塑料可广泛用于医药、食品包装和一次性餐具等方面 |
目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如右图) 。关于此循环体系,下列说法中错误的是
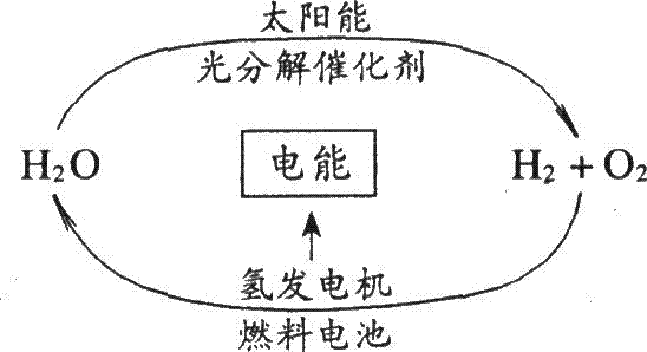 A.燃料电池能够使化学反应产生的能量转化为电能
A.燃料电池能够使化学反应产生的能量转化为电能
B.在此循环中发生了反应:2H2O![]() H2↑+O2↑
H2↑+O2↑
C.该氢能源的循环体系能够实现太阳能转化为电能
D.目前化学家急需解决的问题是寻找合适的光照条件下
分解水的催化剂
 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
| ||
| ||

| 是否正确 | 简述理由 | |
| 学生1的观点 | 否 否 |
海水中镁离子浓度小,沉淀剂的用量大,不利于镁离子的沉淀 海水中镁离子浓度小,沉淀剂的用量大,不利于镁离子的沉淀 |
| 学生2的观点 | 否 否 |
能源消耗大,海水的综合利用低,成本高 能源消耗大,海水的综合利用低,成本高 |
| 学生3的观点 | 是 是 |
镁离子富集浓度高,成本低 镁离子富集浓度高,成本低 |
| ||
| ||

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com