
题目列表(包括答案和解析)
(16分)碳和碳的化合物在生产生活实际中应用广泛。运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)常温下,碳酸在水中的电离常数Ka1=4.2×10-7 ,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式 ;
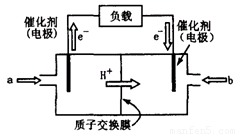
(2)上图为常用笔记本电脑所用的甲醇质子交换膜燃料电池的结构示意图。电池总反应为2CH3OH+3O2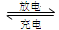 2CO2+4H2O。该装置放电时 (填“a”或“b”)为电池的负极,其电极反应式为
;
2CO2+4H2O。该装置放电时 (填“a”或“b”)为电池的负极,其电极反应式为
;
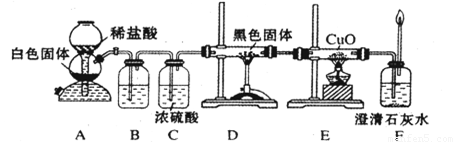
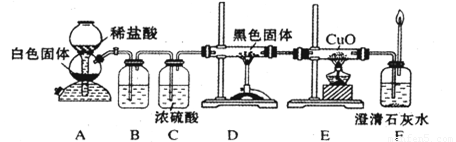
(3)CO具有还原性,某化学研究小组为证明CO具有还原性,设计了如图所示的实验装置。
已知:C + H2O CO+H2 CO + H2O
CO+H2 CO + H2O CO2 + H2 C + CO2
CO2 + H2 C + CO2 2CO
2CO
试回答下列问题:
① 装置B中最适宜的试剂是 ,必须用装置C吸收气体中的水蒸气的理由是 ;
② 根据该实验中的 现象,可证明CO具有还原性;
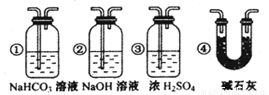
③ 若要根据装置F中石灰水变浑浊的现象准确确认CO具有还原性,则应在上图装置 与 之间(填字母标号)连接下图中的 装置(选填序号)。
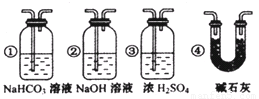
(10分)CO具有还原性,某化学研究小组为证明CO具有还原性,设计了如图所示的实验装置。
已知:C + H2O CO+H2 CO + H2O
CO+H2 CO + H2O CO2 + H2 C + CO2
CO2 + H2 C + CO2 2CO
2CO
试回答下列问题:
① 装置B中最适宜的试剂是 ,必须用装置C吸收气体中的水蒸气的理由是 ;
② 根据该实验中的 现象,可证明CO具有还原性;
③ 若要根据装置F中石灰水变浑浊的现象准确确认CO具有还原性,则应在上图装置 与 之间(填字母标号)连接右图中的 装置(选填序号)。
(16分)碳和碳的化合物在生产生活实际中应用广泛。运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka = 4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式 ;
4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式 ;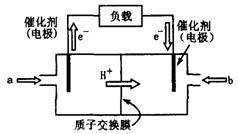
(2)上图为常用笔记本电脑所用的甲醇质子交换膜燃料电池的结构示 意图。电池总反应为2CH3OH+3O2
意图。电池总反应为2CH3OH+3O2 2CO2+4H2O。该装置放电时 (填“a”或“b”)为电池的负极,其电极反应式为 ;
2CO2+4H2O。该装置放电时 (填“a”或“b”)为电池的负极,其电极反应式为 ;
(3)CO具有还原性,某化学研究小组为证明CO具有还原性,设计了如图所示的实验装置。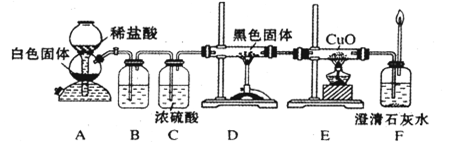
已知:C + H2O CO+H2 CO + H2O
CO+H2 CO + H2O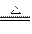 CO2 +
CO2 +  H2 C + CO2
H2 C + CO2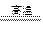 2CO
2CO
试回答下列问题:
①装置B中最适宜的试剂是 ,必须用装置C吸收气体中的水蒸气的理由是 ;
②根据该实验中的 现象,可证明CO具有还原性;
③若要根据装置F中石灰水变浑浊的现象准确确认CO具有还原性,则应在上图装置 与 之间(填字母标号)连接下图中的 装置(选填序号)。
(10分)CO具有还原性,某化学研究小组为证明CO具有还原性,设计了如图所示的实验装置。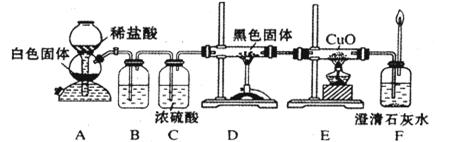
已知:C + H2O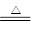 CO+H2 CO + H2O
CO+H2 CO + H2O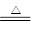 CO2 + H2 C + CO2
CO2 + H2 C + CO2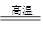 2CO
2CO
试回答下列问题:
①装置B中最适宜的试剂是 ,必须用装置C吸收气体中的水蒸气的理由是 ;
②根据该实验中的 现象,可证明CO具有还原性;
③若要根据装置F中石灰水变浑浊的现象准确确认CO具有还原性,则应在上图装置 与 之间(填字母标号)连接右图中的 装置(选填序号)。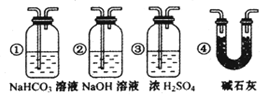
在同温同压条件下,已知: C+CO2 2CO(正反应是吸热),正反应的反应速率为v1;N2+3H2
2CO(正反应是吸热),正反应的反应速率为v1;N2+3H2 2NH3(正反应是放热),正反应的反应速率为v2。对于上述反应,当温度同时升高时,v1 和v2的变化情况正确的是
2NH3(正反应是放热),正反应的反应速率为v2。对于上述反应,当温度同时升高时,v1 和v2的变化情况正确的是
A.同时增大 B.同时减小
C.v1增大,v2减小 D.v1减小,v2增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com