
题目列表(包括答案和解析)
(8分)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
 ①2Mg+O2
①2Mg+O2 2MgO;
2MgO;
②3Mg+N2  Mg3N2;
Mg3N2;
③2Mg+CO2 2MgO+C;
2MgO+C;
④Mg+H2O MgO+H2↑;
MgO+H2↑;
⑤Mg3N2 +6H2O =3Mg(OH)2↓+2NH3↑
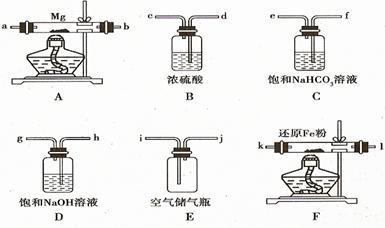
 可供选择的装置和药品如上图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。回答下列问题
可供选择的装置和药品如上图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。回答下列问题

 (1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)
。
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)
。
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号) 。
 (3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?
,原因是 。
(4)请设计一个实验,验证产物是氮化镁: 。
(8分)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
①2Mg+O22MgO;
②3Mg+N2 Mg3N2;
③2Mg+CO22MgO+C;
④Mg+H2OMgO+H2↑;
⑤Mg3N2 +6H2O =3Mg(OH)2↓+2NH3↑
可供选择的装置和药品如上图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。回答下列问题
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号) 。
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号) 。
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?
,原因是 。
(4)请设计一个实验,验证产物是氮化镁: 。
| |||||||||||||||

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
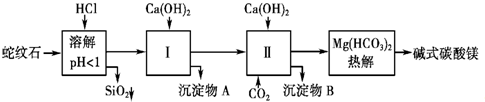
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com