
题目列表(包括答案和解析)

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| pH | 3.4 | 5.2 | 12.4 |

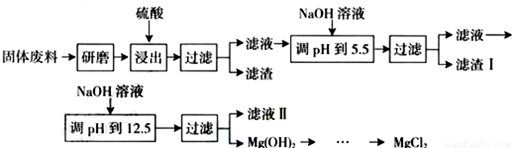
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| pH | 3.4 | 5.2 | 12.4 |
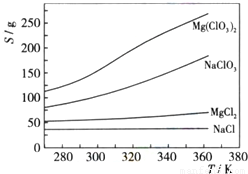
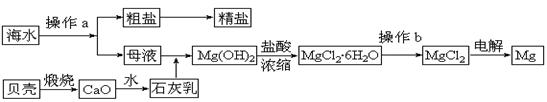
海水是一种丰富的资源,工业上从海水中可提取许多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。
回答下列问题:
(1)流程图中操作a的名称为 。
(2)工业上从海水中提取的NaCl,可用来制取纯缄,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①气体A、B是CO2或NH3,则气体A应是 (填化学式)。
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品NH4Cl晶体,则通入NH3的作用是
。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是:
。
②操作b是在 氛围中进行,若在空气中加热,则会生成Mg(OH)Cl,写出有关反应的化学方程式: 。
(10分)海水是一种丰富的资源,工业上从海水中可提取许多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。
回答下列问题:
(1)流程图中操作a在蒸发结晶后进行 (填操作名称)。
(2)工业上从海水中提取的NaCl,可用来制取纯缄,其简要过程如下:向饱和食盐水中
先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①气体A、B是CO2或NH3,则气体A应是 (填化学式)。
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品NH4Cl晶体,则通入NH3的作用是 。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是:
。
②操作b是在 氛围中进行,若在空气中加热,则会生成Mg(OH)Cl。
(10分)海水是一种丰富的资源,工业上从海水中可提取许多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。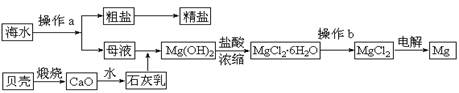
回答下列问题:
(1)流程图中操作a在蒸发结晶后进行 (填操作名称)。
(2)工业上从海水中提取的NaCl,可用来制取纯缄,其简要过程如下:向饱和食盐水中
先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①气体A、B是CO2或NH3,则气体A应是 (填化学式)。
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品NH4Cl晶体,则通入NH3的作用是 。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是:
。
②操作b是在 氛围中进行,若在空气中加热,则会生成Mg(OH)Cl。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com