
题目列表(包括答案和解析)
(16分)Ⅰ.下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的某性质)


把与下面元素有关性质相符的曲线标号填入相应括号中:
⑴ⅡA族元素的最外层电子数 ( ) ⑵第三周期元素的最高化合价 ( )
⑶第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径( )
⑷第二、三周期元素随原子序数递增原子半径的变化(不包括惰性气体) ( )
⑸碱金属的阳离子氧化能力(不包括钫)( )
Ⅱ.下图是元素周期表的一部分
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑴请在表中画出金属与非金属的交界线 ⑵请在表中标出第VIII的位置
⑶在表中标出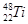 的位置
的位置
(16分)Ⅰ.下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的某性质)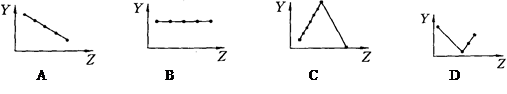
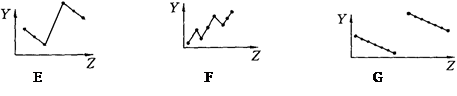
把与下面元素有关性质相符的曲线标号填入相应括号中:
⑴ⅡA族元素的最外层电子数 ( ) ⑵第三周期元素的最高化合价( )
⑶第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径( )
⑷第二、三周期元素随原子序数递增原子半径的变化(不包括惰性气体) ( )
⑸碱金属的阳离子氧化能力(不包括钫)( )
Ⅱ.下图是元素周期表的一部分
| | | | |||||||||||||||
| |  | | | | | | | | |||||||||
| | | | | | | | | ||||||||||
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | ||||||||
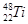 的位置
的位置Ⅰ.下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y
为元素的某性质)

 |
把与下面元素有关性质相符的曲线标号填入相应括号中:
⑴ⅡA族元素的最外层电子数 ( ) ⑵第三周期元素的最高化合价 ( )
⑶第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径( )
⑷第二、三周期元素随原子序数递增原子半径的变化(不包括惰性气体) ( )
⑸碱金属的阳离子氧化能力(不包括钫)( )
Ⅱ.下图是元素周期表的一部分
|
| |||||||||||||||||
| |||||||||||||||||
⑴请在表中画出金属与非金属的交界线 ⑵请在表中标出第VIII的位置
⑶在表中标出![]() 的位置
的位置






| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com