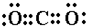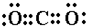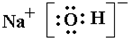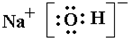有A、B、C、D、E五种元素,A元素形成的-2价阴离子比氦的核外电子数多8个.B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质.C为原子核内有12个中子的二价金属,当2.4g C与足量盐酸反应时,生成标准状况下的H
2 2.24L.D的原子M层上有7个电子,E与A同周期且最外层比次外层多3个电子.
(1)C离子的结构示意图
.
(2)A、E氢化物的稳定性比较
H2O>NH3
H2O>NH3
.(填化学式)
(3)A、B、C、D四种离子半径由大到小顺序
Cl->O2->Na+>Mg2+
Cl->O2->Na+>Mg2+
(用离子符号表示)
(4)写出Cu与E的最高价氧化物对应水化物稀溶液反应的离子反应方程式:
3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
.
(5)在一种含有A元素的有18个电子的化合物和稀盐酸的混合物中加入铜片,溶液变为蓝色,写出该反应的离子反应方程式
Cu+H2O2+2H+═Cu2++2H2O
Cu+H2O2+2H+═Cu2++2H2O
.
(6)写出实验室制E的氢化物的化学反应方程式
2NH
4Cl+Ca(OH)
2CaCl
2+2NH
3↑+2H
2O
2NH
4Cl+Ca(OH)
2CaCl
2+2NH
3↑+2H
2O
.