
题目列表(包括答案和解析)
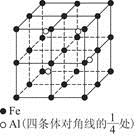
为缓解北京地区的旱情,有关部门选择适宜的条件和方法,向大气中发射催雨剂,其主要成分是干冰(固态CO2)、液氮、碘化银等。下列有关叙述不正确的是
A.干冰是由分子构成的晶体
B.干冰和液氮的分子中都有非极性共价键
C.干冰和液氮催雨的原理都属于物理变化
D.碘化银粒在冷云中产生冰晶,起到催雨作用
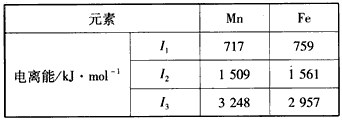
 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.| 元 素 | Mn | Fe | |
| 电离能 /kJ?mol-1 |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
第四周期过渡元素Mn、Fe、Ti、Ni可与C、H、O形成多种化合物。
(1)下列叙述正确的是__________。(填字母)
A. CH2O与水分子间能形成氢键
B. CH2O和CO2分子中的中心原子均采用sp2杂化
C. C6H6分子中含有6个![]() 键和1个大
键和1个大![]() 键,C6H6是非极性分子
键,C6H6是非极性分子
D. CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)H、C、N、O四种元素的电负性由小到大的顺序为__________。
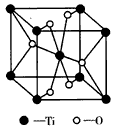
(3)已知Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物,其配离子结构如图所示。

①Fe元素基态原子价电子排布式为__________。
②1molCN-中![]() 键数目为__________。
键数目为__________。
③上述沉淀溶解过程的化学方程式为____________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com