
题目列表(包括答案和解析)
| 元素 | A | B | D | E | F | G | M | N | P |
| 原子半径/nm | 0.077 | 0.070 | 0.066 | 0.064 | 0.186 | 0.160 | 0.143 | 0.104 | 0.099 |
| 元素 | A | B | D | E | F | G | M | N | P |
| 原子半径/nm | 0.077 | 0.070 | 0.066 | 0.064 | 0.186 | 0.160 | 0.143 | 0.104 | 0.099 |
 MgS
MgS
| 元素 | W | X | Y | Z |
| 原子半径 | 186pm | 99pm | 66pm | 77pm |
| 核外电子 | 有4种能级不同的电子 | 最外层有7种运动状态不同的电子 | 核外电子占有5个轨道 | 有2个未成对电子 |
| 单质 部分 性质 |
密度:0.97g?cm-3 熔点:97.8℃ 能导电 |
沸点:-34.0℃ 不能导电 |
密度:1.43g?L-1 沸点:-183.0℃ 不能导电 |
熔点:3550℃ 能导电 |
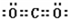
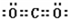
| 元素 | W | X | Y | Z |
| 原子半径 | 186pm | 99pm | 66pm | 77pm |
| 核外电子 | 有4种能级不同的电子 | 最外层有7种运动状态不同的电子 | 核外电子占有5个轨道 | 有2个未成对电子 |
| 单质 部分 性质 | 密度:0.97g?cm-3 熔点:97.8℃ 能导电 | 沸点:-34.0℃ 不能导电 | 密度:1.43g?L-1 沸点:-183.0℃ 不能导电 | 熔点:3550℃ 能导电 |
 (2011?福建模拟)原子序数递增的部分短周期主族元素的原子半径数据如下表:
(2011?福建模拟)原子序数递增的部分短周期主族元素的原子半径数据如下表:| 元素 | A | B | D | E | F | G | M | N | P |
| 原子半径/nm | 0.077 | 0.070 | 0.066 | 0.064 | 0.186 | 0.160 | 0.143 | 0.104 | 0.099 |


| ||
| ||
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com