
题目列表(包括答案和解析)
| A、AB2、B2分别为0.4mol/L、0.2mol/L | B、AB2为0.25mol/L | C、AB2、AB3均为0.15mol/L | D、AB3为0.4mol/L |
| A、SO2,O2分别为0.4,0.3mol/L | B、SO2为0.25mol/L | C、SO2,SO3均为0.15mol/L | D、SO3为0.4mol/L |
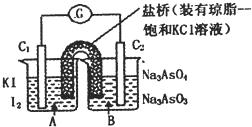 已知反应AsO43-+2I一+2H+?AsO43-+I2+H2O是可逆反应.设计如图装置(C1、C2均为石墨电极),分别进行下述操作.
已知反应AsO43-+2I一+2H+?AsO43-+I2+H2O是可逆反应.设计如图装置(C1、C2均为石墨电极),分别进行下述操作.
| A、SO2为0.4mol/L | B、SO2为0.25mol/L | C、O2为0.2mol/L | D、O2为0mol/L |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com