
题目列表(包括答案和解析)
 某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如图所示:
某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如图所示:| 实验编号 | 水温/℃ | 液面上升高度 | ||
| 1 | 25 | 超过试管的
| ||
| 2 | 50 | 不足试管的
| ||
| 3 | 0 | 液面上升超过实验1 |
某实验小组为研究草酸的制取和草酸的性质,进行如下实验。
实验I:制备草酸
实验室用硝酸氧化淀粉水解液制备草酸的装置如图所示(加热、搅拌和仪器固定装置均已略去),实验过程如下:
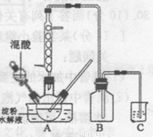
①将一定量的淀粉水解液加人三颈瓶中
②控制反应液温度在55〜600C条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸 (65%HNO3与98%H2S04的质量比为2 :1.5)溶液
③反应3h左右,冷却,抽滤后再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2↑+8NO↑+10H2O
3 H2C2O4+2HNO3→6CO2↑+2NO↑+4H2O
(1)检验淀粉是否水解完全所需用的试剂为________。
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是________。
实验II :草酸晶体中结晶水测定
草酸晶体的化学式可表示为H2C2O4 • xH2O,为测定x的值,进行下列实验:
①称取6.3g某草酸晶体配成100.0mL的水溶液。
②取25.00mL所配溶液置于锥形瓶中,加入适量稀H2SO4,用浓度为0. 5mol/L的KMnO4溶液滴定,滴定终点时消耗KMnO4 的体积为10.00mL。回答下列问题:
(3)写出上述反应的离子方程式________________。
(4)计算x=________。
(5)滴定时,常发现反应速率开始很慢,后来逐渐加快,可能的原因是________。
实验III:草酸不稳定性
查阅资料:草酸晶体(H2C2O4 •xH20),1000C开始失水,100.5℃左右分解产生H2O、CO和CO2。请用下图中提供的仪器及试剂,设计一个实验,证明草酸晶体分解得到的混合气中有H2O、CO和CO2 (加热装置和导管等在图中略去,部分装置可重复使用)。

回答下列问题:
(6)仪器装置按连接顺序为________。
(7)仪器B中无水硫酸铜的作用________。
(8)能证明混合气中含有CO的实验依据是________。
某实验小组为研究草酸的制取和草酸的性质,进行如下实验。
实验I:制备草酸
实验室用硝酸氧化淀粉水解液制备草酸的装置如图所示(加热、搅拌和仪器固定装置均已略去),实验过程如下:
①将一定量的淀粉水解液加人三颈瓶中
②控制反应液温度在55?600C条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸 (65%HNO3与98%H2S04的质量比为2 :1.5)溶液
③反应3h左右,冷却,抽滤后再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2↑+8NO↑+10H2O
3 H2C2O4+2HNO3→6CO2↑+2NO↑+4H2O
(1)检验淀粉是否水解完全所需用的试剂为________。
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是________。
实验II:草酸晶体中结晶水测定
草酸晶体的化学式可表示为H2C2O4? xH2O,为测定x的值,进行下列实验:
①称取6.3g某草酸晶体配成100.0mL的水溶液。
②取25.00mL所配溶液置于锥形瓶中,加入适量稀H2SO4,用浓度为0. 5mol/L的KMnO4溶液滴定,滴定终点时消耗KMnO4的体积为10.00mL。回答下列问题:
(3)写出上述反应的离子方程式________________。
(4)计算x=________。
(5)滴定时,常发现反应速率开始很慢,后来逐渐加快,可能的原因是________。
实验III:草酸不稳定性
查阅资料:草酸晶体(H2C2O4 ?xH20),1000C开始失水,100.5℃左右分解产生H2O、CO和CO2。请用下图中提供的仪器及试剂,设计一个实验,证明草酸晶体分解得到的混合气中有H2O、CO和CO2 (加热装置和导管等在图中略去,部分装置可重复使用)。
回答下列问题:
(6)仪器装置按连接顺序为________。
(7)仪器B中无水硫酸铜的作用________。
(8)能证明混合气中含有CO的实验依据是________。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com