
题目列表(包括答案和解析)
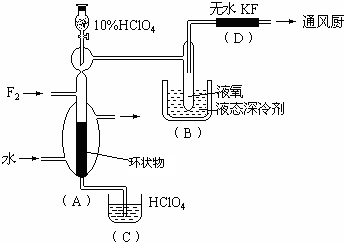
(08揭阳市一模)(12分)制取氟的氧氯化物X可采用特制的耐氟容器,使氟气缓缓地与10%的HClO4反应。X中各元素的质量分数为:Cl占30%,O占54%,F占16%。其实验装置如下图所示:

已知有关有资料如下:
①无水KF易吸F2、HF和H2O
②X的熔点为-167℃,沸点为-15.9℃,易分解或接触有机物发生爆炸
③F2的沸点为-188℃,HF的沸点为19.54℃,O2的沸点为-183℃
试回答:
(1)X的化学式是 。
(2)实验中生成X的化学方程式
是 。
(3)D装置的作用是 。
(4)B中冷却剂选用液氧的理由是
。
(5)A中填充环状物的作用是
(6)有人用石墨为填充剂,结果无X生成。石墨加入导致不能生成X的主要理由是 。
《实验化学》
制取氟的氧氯化物X可采用特制的耐氟容器,使氟气缓缓地与10%的HClO4反应.X中各元素的质量分数为:Cl占30%,O占54%,F占16%.其实验装置如下图所示:
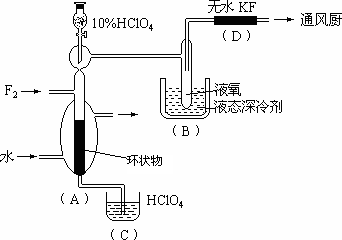
已知有关有资料如下:
①无水KF易吸F2、HF和H2O ②X的熔点为-167℃,沸点为-15.9℃,易分解或接触有机物发生爆炸 ③F2的沸点为-188℃,HF的沸点为19.54℃,O2的沸点为-183℃
试回答:
(1)X的化学式是________.(2)实验中生成X的化学方程式是________.
(3)D装置的作用是________.
(4)B中冷却剂选用液氧的理由是___________________.
(5)A中填充环状物的作用是________________________
(6)有人用石墨为填充剂,结果无X生成.石墨加入导致不能生成X的主要理由是____________________.
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (K) |
7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
 ,下列说法正确的是
,下列说法正确的是 SO2Cl2(l)△H=-97.3kJ?mol-1
SO2Cl2(l)△H=-97.3kJ?mol-1
 阴极获得钛可能发生的反应或电极反应为:
阴极获得钛可能发生的反应或电极反应为: ,下列说法正确的是
,下列说法正确的是湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com