为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
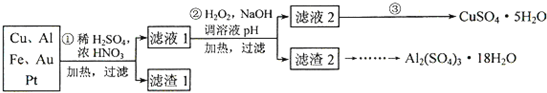
(1)第①步Cu与混酸反应的离子方程式为______.得到滤渣1的主要成分为______.
(2)第②步中加入H
2O
2的作用是______,使用H
2O
2的优点是______;调溶液pH的目的是______.
(3)简述第③步由滤液2得到CuSO
4?5H
2O的方法是______.
(4)由滤渣2制取Al
2(SO
4)
3?18H
2O,设计了以下三种方案:
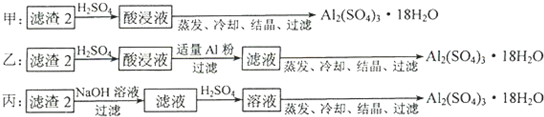
上述三种方案中,______方案不可行,原因是______;从原子利用率角度考虑,______方案更合理.
(5)用滴定法测定CuSO
4?5H
2O含量.取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用
cmol/LEDTA(H
2Y
2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL.滴定反应如下:
Cu
2++H
2Y
2-→CuY
2-+2H
+.写出计算CuSO
4?5H
2O质量分数的表达式ω=______.


