
题目列表(包括答案和解析)
A物质的化学式为XY2,X、Y为元素周期表前三周期的元素,其阳离子和阴离子电子层结构相同,且1 mol XY2含有30 mol电子.请回答下列问题:
(1)X基态原子的核外电子排布式为________,A物质的化学式________.
(2)元素D、E同周期,D原子的最外层电子数是其电子层数的3倍,D与Y相邻,则D的离子结构示意图是________;E原子的最外层电子数是其电子层数的2倍,D与E形成非极性分子,该分子的结构式为________.
(3)W为短周期元素,且与E同主族,其单质是________晶体;DW形成的晶体的化学式是______________.
(4)Y的氢化物能用于刻蚀玻璃,Y2与NaOH溶液反应的产物之一是OY2,该反应的离子方程式为________.
下图所示装置工作时均与H2有关。

图1 图2 图3
(1) 图1所示装置中阳极的电极反应式为 。
图2所示装置中,通入H2的管口是 (选填字母代号)。
某同学按图3所示装置进行实验,生成固体的主要成分是Fe3O4,其组成也可以表示成FeO·Fe2O3。现提供以下试剂,从中选择合适的药品,证明生成固体中存在+2价铁元素。
试剂:稀盐酸、稀硫酸、稀硝酸、NaOH溶液、KSCN溶液、KMnO4溶液、氯水
选择的药品________
(2)工业上利用水煤气合成二甲醚的三步反应如下:
a.2H2(g)+CO(g) ![]() CH3OH(g) △H1=-90.8kJ•mol-1
CH3OH(g) △H1=-90.8kJ•mol-1
b.2 CH3OH(g) ![]() CH3OCH3 (g) +H2O(g)△H2=-23.5kJ•mol-1
CH3OCH3 (g) +H2O(g)△H2=-23.5kJ•mol-1
c. CO(g) +H2O(g) ![]() H2(g)+CO2 (g) △H3=-41.3kJ•mol-1
H2(g)+CO2 (g) △H3=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g) ![]() CH3OCH3 (g) + CO2 (g)的
CH3OCH3 (g) + CO2 (g)的![]() 。
。
 (3)用Na2CO3熔融盐作电解质,CO、O2
(3)用Na2CO3熔融盐作电解质,CO、O2
为原料组成的新型电池的研究取得了重大突破。
该电池示意图如右:
负极电极反应式为________________,
为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环。A物质的化学式为__________________。
(4) C1化合物在治理汽车尾气方面也大有可为,如CO、CH4等在一定条件下均可以与氮氧化物生成无污染的物质。写出CO与氮氧化物(NOx)在有催化剂的条件下反应的化学方程式 。

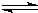 M(OH)2
M(OH)2 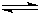 2H++MO22-
2H++MO22-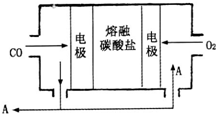 (2013?德州模拟)钠及其化合物具有广泛的用途.
(2013?德州模拟)钠及其化合物具有广泛的用途.
| ||
| ||
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com