
题目列表(包括答案和解析)
| |||||||||||||||||||||||||||||||||||
联碱法(侯氏制碱法)和氨碱法的生产流程简要表示如下图: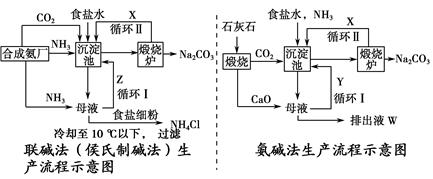
(1)沉淀池中发生反应的化学方程式为________________。
(2)X是________,Y是________(填化学式)。
(3)Z中除了溶解的氨气、食盐外,其它溶质还有________________;排出液W中的溶质除了氢氧化钙外,还有________________。
(4)从理论上分析,在氨碱法生产过程中________(填“需要”或“不需要”)补充氨气。
(5)根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是________(填序号)。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
(6)联碱法与氨碱法相比,指出联碱法的一项优点___________________。
联碱法(侯氏制碱法)和氨碱法的生产流程简要表示如下图:
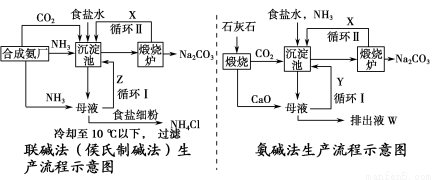
(1)沉淀池中发生反应的化学方程式为________________。
(2)X是________,Y是________(填化学式)。
(3)Z中除了溶解的氨气、食盐外,其它溶质还有________________;排出液W中的溶质除了氢氧化钙外,还有________________。
(4)从理论上分析,在氨碱法生产过程中________(填“需要”或“不需要”)补充氨气。
(5)根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是________(填序号)。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
(6)联碱法与氨碱法相比,指出联碱法的一项优点___________________。
Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下: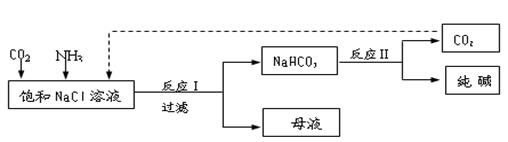 k+s-5#
k+s-5#
已知NaHCO3在低温下溶解度较小。反应Ⅰ为:NaCl+CO2+NH3+H2O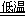 NaHCO3↓+NH4Cl,处理母液的两种方法如下:
NaHCO3↓+NH4Cl,处理母液的两种方法如下:
(1)向母液中加入石灰乳,可将其中________循环利用。
(2)向母液中通入NH3,加入细小的食盐颗粒并降温,可得到NH4Cl晶体。试写出通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式 _____________________________。
Ⅱ.某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。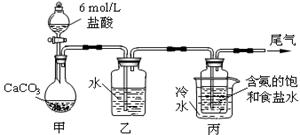
(1)装置丙中冷水的作用是 ;
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有_______、洗涤、灼烧。NaHCO3转化为Na2CO3的化学方程式为 ;
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3 样品的组成进行了以下探究。取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。则曲线a对应的溶液中的离子是___________(填离子符号下同);曲线c对应的溶液中的离子是___________;该样品中NaHCO3和Na2CO3的物质的量之比是 ;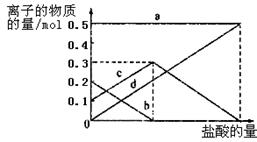
(4)若取21.0 g NaHCO3固体,加热了t2 rnin后,剩余固体的质量为l4.8 g。如果把此剩余固体全部加入到200 mL 2 mol?L—1的盐酸中,则充分反应后溶液中H+ 的物质的量浓度为____________(设溶液体积变化忽略不计)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com