
题目列表(包括答案和解析)
(14分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |

| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |

有关元素A、B、C、D、E的信息如下:
| 元素 | 有关信息 |
| A | 元素主要化合价为-2,A的一种氢化物可用于实验室制取A的单质 |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子中含10个P电子 |
| D | 最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 |
| E | 生活中常见金属,它有两种氯化物,相对原子质量相差35.5 |
请回答下列问题:
 (1)元素A~E中两种元素组成的化合物使品红溶液褪色的物质的化学式为______。
(1)元素A~E中两种元素组成的化合物使品红溶液褪色的物质的化学式为______。
(2)E元素与B元素可形成EB2和EB3两种化合物,下列说法正确的是(填序号)________。
①保存EB2溶液时,需向溶液中加入少量E单质
②EB2只能通过置换反应生成,EB3只能通过化合反应生成
③铜片、碳棒和EB3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴EY3的浓溶液,原无色溶液都变为紫色
(3)用化学符号表示D2C的水溶液中各粒子的浓度关系,如c(C2-)=______________。
(4)将一定量的B单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中含有三种含B元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如下图所示。该苛性钾溶液中KOH的质量是___________,该反应中转移电子的物质的量是_________。
(5)工业上冶炼E单质的化学方程式为__________________________________。
已知一个12C的质量为 a g,一个18O的质量为b g,阿伏伽德罗常数的数值为NA,则下列说法中不正确的是
A.18O的摩尔质量为:bNA
g/mol B.氧元素的相对原子质量:
C. m g该氧原子的物质的量为: mol D.a=
mol D.a=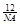
| A.18O的摩尔质量为:bNA g/mol | B.氧元素的相对原子质量: |
C.m g该氧原子的物质的量为: mol mol | D.a= |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com