
题目列表(包括答案和解析)
| |||||||||||||||||||||
| A、水加热到很高温度也很难分解,是因为水分子之间存在氢键 | B、盐酸和NaOH溶液反应的中和热为57.3kJmol,则H2S04溶液和Ca(OH)2溶液反应的中和热为114.6kJmol | C、为防止碳素钢菜刀生锈,使用后应该用食盐水浸泡后放置 | D、若R2-和M+的电子层结构相同,则离子半径:R2一>M+ |

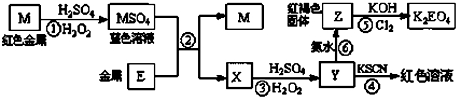
| A、M、E都是第四周期中的过渡元素,E的金属活动性比M的金属活动性强,E3+的氧化性比M2+的氧化性弱 | B、反应⑤的离子方程式可表示为:2E(OH)3+3Cl2+6H2O═3EO42-+6Cl-+12H+ | C、反应①、②、③、⑤都属于氧化还原反应,且在反应①和③中硫酸仅表现了酸性 | D、用K2EO4、Zn可制成一种高能电池,该电池中负极的电极反应式为:EO42-+4H2O+3e-═E(OH)3+5OH- |
| A、由于水中存在氢键,所以稳定性:H2O>H2S | B、由于二氧化硅的相对分子质量比二氧化碳的大,所以沸点:SiO2>CO2 | C、分散质粒子的直径:Fe(OH) 3悬浊液>Fe(OH)3胶体>FeCl3溶液 | D、若R2-和M+的电子层结构相同,则原子半径R>M |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com