
题目列表(包括答案和解析)
|
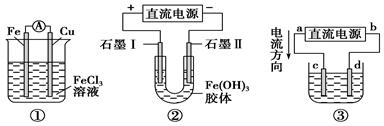
关于下图所示各装置的叙述中,正确的是
| |
| [ ] | |
A. |
装置①是原电池,总反应是:Cu+2Fe3+ |
B. |
装置①中,铁做负极,电极反应式为:Fe3++e-=Fe2+ |
C. |
装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深 |
D. |
若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
关于如图所示各装置的叙述中,正确的是
| A.装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| B.装置①中,铁作负极,电极反应式为:Fe3++e-=Fe2+ |
| C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深 |
| D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
| A.装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| B.装置①中,铁作负极,电极反应式为:Fe3++e-=Fe2+ |
| C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深 |
| D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
|
关于下图所示各装置的叙述中,正确的是
| |
| [ ] | |
A. |
装置①是原电池,总反应是:Cu+2Fe3+ |
B. |
装置①中,铁做负极,该电极反应式为:Fe3++e- |
C. |
装置②为铁上镀铜装置c为纯铜电极 |
D. |
若用装置②精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |

| A.装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| B.装置①中,铁作负极,电极反应式为:Fe3++e-=Fe2+ |
| C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深 |
| D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com