
题目列表(包括答案和解析)
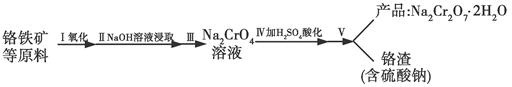
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。

①步骤Ⅰ中反应的化学方程式为:
4FeO·Cr2O3(s)+8Na2CO3(s)+7O2![]() 8Na2CrO4(s)+2Fe2O3(s)+8CO2
8Na2CrO4(s)+2Fe2O3(s)+8CO2
该反应的化学平衡常数的表达式为____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________。
A.升高温度 B.将原料粉碎
C.增加纯碱的用量 D.通入过量的空气
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是________________________。
③步骤Ⅲ需将溶液的pH调至7—8并煮沸,其目的是_______________________________。
④步骤Ⅳ中发生反应的离子方程式为__________________。
(2)将红矾钠与KCl固体按1∶2(物质的量之比)混合溶于水后经适当操作可得到K2Cr2O7晶体。请填写表中空格,完成上述过程。
序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
① | 溶解 | 将混合物放入烧杯中,加水,充分搅拌直到固体不再溶解 |
② |
|
|
③ |
|
|
④ |
|
|
⑤ | 过滤、干燥 | 得到K2Cr2O7晶体 |
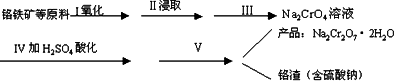
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中做辅助剂,在化学工业和制药工业中也可做氧化剂,应用领域十分广泛。实验室中红矾钠可用一种铬铁矿(主要成分:FeO·Cr2O3,还含有少量的Al2O3)通过以下过程来制取。
回答下列问题:
(1)步骤Ⅰ中反应化学方程式为4FeO2·Cr2O3(s)+8Na2CO3(s)+7O2(g)=8Na2CrO4(s)+2Fe2O3(s)+8CO2(g)。
①在实验室,步骤Ⅰ应在________(填“陶瓷”或“铁”)坩埚中完成。
②在常温下该反应速率极慢,下列措施中能使反应速率增大的是________(填字母)。
A.将原料粉碎 B.增加纯碱的用量 C.升高温度
(2)步骤Ⅱ中NaOH的作用是________________________(用化学反应方程式表示)。
(3)步骤Ⅳ中发生反应的离子方程式为________;反应完成的标志是________。
(4)利用下面的复分解反应,将红矾钠与KCl固体按1?2物质的量之比混合溶于水后经适当操作可得到K2Cr2O7晶体:Na2Cr2O7+2KCl=K2Cr2O7+2NaCl(已知:温度对氯化钠的溶解度影响很小,对重铬酸钾的溶解度影响较大)
基本实验步骤为①溶解;②________;③________;④冷却,结晶,再过滤得K2Cr2O7晶体。其中③应在________(填“高温”或“低温”)条件下进行。
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中有重要用途,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛.
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取.
①步骤Ⅰ中反应的化学方程式为:
4FeO·Cr2O3(s)+8Na2CO3(s)+7O2(g)![]() 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g),ΔH<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g),ΔH<0
该反应的化学平衡常数的表达式为________.
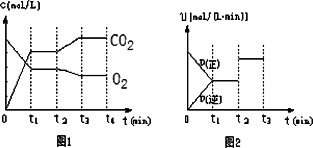
②图1、图2表示该反应在t1时达到平衡、在t2时因改变某个条件而发生变化的曲线:
由图1判断,反应进行至t2 min时,曲线发生变化的原因是________________.
由图2判断,t2 min到t3 min的曲线变化的原因可能是________(填编号)
a.升高温度 b.加了催化剂 c.将原料粉碎 d.缩小容器体积
(2)步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是________、________.
①步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是________________.
②步骤Ⅳ中发生反应的离子方程式为:________.
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛.
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取.
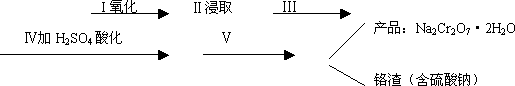
①步骤Ⅰ中反应的化学方程式为:
4FeO·Cr2O3(s)+8Na2CO3(s)+7O2=8Na2CrO4(s)+2Fe2O3(s)+8CO2
该反应的化学平衡常数的表达式为________,在常温下该反应速度极慢,下列措施中能使反应速率增大的是________.
A.升高温度
B.通入过量的空气
C.将原料粉碎
D.增加纯碱的用量
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是________、________.
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是________.
④步骤Ⅳ中发生反应的离子方程式为:________.
(2)将红矾钠与KCl固体1∶2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体.请填写表中空格.完成上述过程.

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com