
题目列表(包括答案和解析)
( 11 分)下图中A~N分别代表化学反应中的一种常见物质。A是一种常见化肥,B在工业上可由G和空气中含量最多的气体制得。常温下,C是液体。E、N、H为金属单质,G、I、M为非金属单质,其中G、M是气体。K是天然气的主要成分,F是具有磁性的黑色晶体。个别反应产物及条件略去。
(1)F的化学式为__________;K分子的空间结构是__________。
(2)反应⑤的条件是____________________。
(3)实验室制取B的化学方程式是________________________________________________。
(4)反应②中,将点燃的H放入盛有D的集气瓶里,可观察到的现象是__________________________
(5)写化学方程式:反应①________________________________________________
反应③________________________________________________。
(6)将F放入稀盐酸中,可生成两种不同价态的金属阳离子。要检验其中的高价态金属阳离子,应加入的试剂是_______________________。
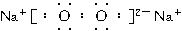
请回答下列问题:
(1)写出C的电子式:_______________。
(2)写出实验室制取B的化学方程式:_____________________________________________。
(3)写出N与K反应的离子反应方程式:___________________________________________。
(4)若混合气体通过碱石灰得到的气体B与通过浓硫酸得到的气体D的质量之比是7∶11,则固体A是_______________。
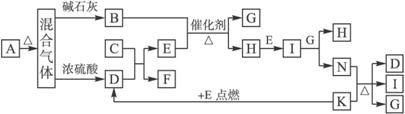
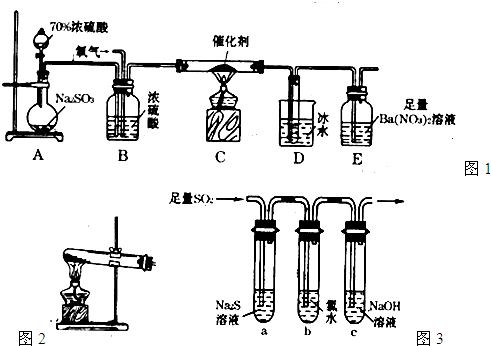
【8分】下图中的B—K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体。固态物质A加热后生成的气体混合物若通过碱石灰,只剩余气体B,若通过浓硫酸则只剩余气体D。各物质间的转化关系如下图所示:
请回答下列问题:
(1)写出C的电子式:_______________。
(2)写出实验室制取B的化学方程式:_____________________________________________。
(3)写出N与K反应的离子反应方程式:___________________________________________。
(4)若混合气体通过碱石灰得到的气体B与通过浓硫酸得到的气体D的质量之比是7∶11,则固体A是_______________。
| ||
| ||
| △ |
| ||
| △ |
| ||||
|
| ||||
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com