
题目列表(包括答案和解析)
 运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义.
运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义.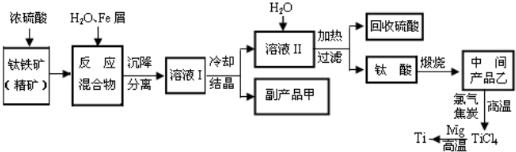
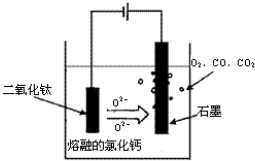
2- 4 |
(16分)化学反应的能量变化、速率、限度是化学研究的重要内容。
(1)有关研究需要得到C3H8(g) = 3C(石墨,s) + 4H2(g)的ΔH,但测定实验难进行。设计下图可计算得到:
①ΔH 0(填>、<或=)
②ΔH =
(用图中其它反应的反应热表示)
(2)甲酸、甲醇、甲酸甲酯是重要化工原料。它们的一些性质如下:
| 物质 | HCOOH | CH3OH | HCOOCH3 |
| 主要 性质 | 无色液体,与水互溶 K(HCOOH)>K(CH3COOH) | 无色液体,与水互溶 | 无色液体,在水中溶解度小,与醇互溶 |
 HCOOH(l) + CH3OH(l),反应吸热,但焓变的值很小。常温常压下,水解反应速率和平衡常数都较小。
HCOOH(l) + CH3OH(l),反应吸热,但焓变的值很小。常温常压下,水解反应速率和平衡常数都较小。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com