
题目列表(包括答案和解析)
酸、碱、盐在水溶液中能导电是因为它们在溶液中发生了________,产生能够自由移动的离子.酸是指电离时生成的阳离子全部都是________的化合物;碱是指电离时生成的阴离子全部都是________的化合物;盐是指电离生成________的化合物.
酸、碱、盐都是电解质,在水中都能电离出离子。
(1)下列溶液中,c(H+)由大到小的排列顺序是 ;pH由大到小的排列顺序是 。
A.0.1 mol/L CH3COOH溶液 B.0.1 mol/L HCl C.0.1 mol/L H2SO4
(2)体积相同、物质的量浓度相同的醋酸溶液与氢氧化钠溶液混合后,溶液呈 (填“酸性”、“碱性”或“中性”);溶液中c(Na+) (填“>”“=”“<”)c(CH3COO―)。
(3)体积相同、pH相同的盐酸和醋酸溶液与氢氧化钠溶液完全中和时,两者消耗的氢氧化钠的物质的量一定 (填“相等”或“不相等”),其原因是
 _____________________________________。
_____________________________________。
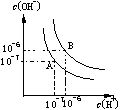
(4)水的电离平衡如右图所示,若A点表示25℃时水的电离平衡状态,当升高温度至100℃时水的电离平衡状态为B点,则此时水的离子积为 。
写出NaHCO3在水溶液中的电离方程式,NaHCO3溶液与盐酸、NaOH溶液反应的离子方程式.依据酸碱质子理论,HCO3-是否可称为酸碱两性物质?
电离:电解质在熔融状态或水溶液中解离成离子的________叫电离.
(1)酸、碱、盐在水溶液中都能电离,所以能导电;离子浓度越大,导电能力________;
(2)金属也能导电,但它________电解质.
(18分)铵盐在工农业生产中有着重要的用途,请根据要求完成下列各题。
Ⅰ.某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液。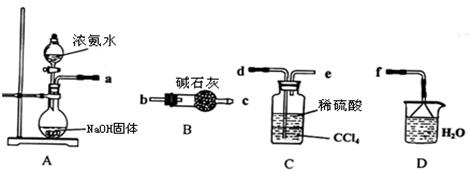
(1)仪器连接的顺序(用接口序号字母表示)是:a
(2)试从电离平衡角度分析该实验装置A中能产生氨气的原因:
。
(3)将装置C中两种液体分离开的操作名称是 。
(4)(NH4)2SO4“低毒,有刺激性,有吸湿性、吸湿后固结成块”。储存应注意 。
Ⅱ.为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁[Mg(OH)Cl]的工艺。某同学根据该原理设计的实验装置如图: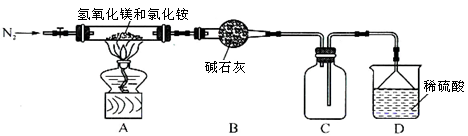
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为 。
(2)反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收,
二是 。
(3)由MgCl2溶液蒸发得到MgCl2·6H2O晶体,蒸发的目的是_________。
a.得到热饱和溶液 b.析出晶体
(4)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是:
。
②由MgCl2·6H2O制备无水MgCl2的操作在 氛围中进行,若在空气中加热,则会生成Mg(OH)Cl。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com