
题目列表(包括答案和解析)
某课外小组设计制备乙酸乙酯的装置如图所示。
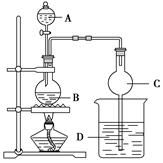
查阅资料得到:
Ⅰ.CaCl2可与乙醇生成难溶于水的混合物CaCl2·2C2H5OH;
Ⅱ.数据:
|
物质 |
乙醇 |
乙酸 |
乙酸乙酯 |
浓硫酸(98%) |
|
沸点/℃ |
78.5 |
117.9 |
77.1 |
338.0 |
实验主要步骤如下:
①按图连接好装置(装置气密性良好),A中盛有浓硫酸,B中盛有乙醇和乙酸钠的混合溶液、碎瓷片,D中盛有含酚酞的饱和Na2CO3溶液。
②用小火均匀加热有混合溶液的烧瓶5~10 min。
③待D收集到一定量产物后停止加热,撤出C,将D混合物搅拌,然后静置待分层。
请根据设计要求帮助解决下列问题:
(1)浓硫酸的作用是
________________________________________________________________________。
(2)实验中饱和碳酸钠溶液的作用是(填字母):________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)该小组将教材实验装置图4-2-3(a)进行了改进,一是反应器大试管换成了烧瓶,其优点是________________;二是在导管中添加了球形干燥管,优点是
________________________________________________________________________
________________________________________________________________________。
步骤②中需要小火均匀加热操作,其主要理由是:
________________________________________________________________________
________________________________________________________________________。
 Ⅰ.铜与稀硝酸反应的离子方程式为
Ⅰ.铜与稀硝酸反应的离子方程式为Ⅰ.(4分)铜与稀硝酸反应的离子方程式为________________;在做铜与稀硝酸反应的实验时,常观察到试管内生成的气体先为浅红棕色,其原因是________________;为了能直接观察到生成的气体的颜色,可在往稀硝酸中加入铜的同时,加入少量碳酸盐,那么加入少量碳酸盐的作用是________________。
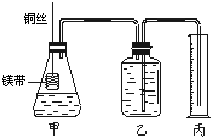
Ⅱ.某研究性学习小组欲证明:在同温同压下,相同浓度、相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如下图。该实验的主要操作步骤如下:

①配制浓度均为1 mol?L-1盐酸和醋酸溶液;
②量取15.00 mL 1 mol?L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端;
④在广口瓶中装足量的水,按图连接好装置,检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录相关数据;
⑥反应结束后待温度恢复到室温,调整乙和丙中液面使二者处于同一平面,读出量筒中水的体积为V mL。
请你参与实验并回答下列问题:
(1)量取15.00 mL 1 mol?L-1盐酸和醋酸溶液所用的仪器是 ;
A.带刻度的烧杯 B.量筒 C.酸式滴定管 D.碱式滴定管
(2)步骤③中a的数值至少是 ;步骤④中检查该装置气密性的操作与观察方法是:____________________;步骤⑤中应记录的数据是 ;
(3)本实验装置丙中量筒的规格是 (填序号)。
A.10mL B.100 mL C.200 mL D.500 mL
(4) 若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm=____;
(5)试简述速率不等的原因是_________;铜丝不与酸接触的原因是_______________。
(6)试写出镁与醋酸溶液反应的离子方程式: 。
某探究学习小组的同学学习氨的性质以后,为了探究氨气的某些性质,设计并进行了以下实验:
(Ⅰ)NH3的制取及收集
1.写出实验制取氨气的化学方程式 ;
2.收集氨气的方法是 。
(II)HCl的制取及收集
实验室通常以反应:2NaCl(晶体)+H2SO4(浓)![]() Na2SO4 + 2HCl↑ 为原理来制取少量HCl气体,试据此分析并回答下列问题:
Na2SO4 + 2HCl↑ 为原理来制取少量HCl气体,试据此分析并回答下列问题:
1.实验室制取HCl气体可选择下列装置中的 ( )
A.实验室制氧气的装置 B.实验室制氢气的装置
C.实验室制二氧化碳的装置 D.实验室制氯气的装置
(III)验证氨气部分性质的探究实验:
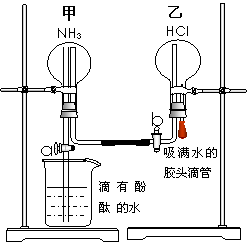 为了同时进行氨气溶于水以及氨气与HCl的反应的探究,同学们积极思考并设计了如下的实验装置图。首先在甲、乙两个干燥的圆底烧瓶中分别收集满了NH3和HCl气体,然后再按如下图所示连接好各个装置(活塞a和b均处于关闭状态),并按以下步骤进行实验:
为了同时进行氨气溶于水以及氨气与HCl的反应的探究,同学们积极思考并设计了如下的实验装置图。首先在甲、乙两个干燥的圆底烧瓶中分别收集满了NH3和HCl气体,然后再按如下图所示连接好各个装置(活塞a和b均处于关闭状态),并按以下步骤进行实验:
1.先挤压胶头滴管再打开活塞b,请你预测此时乙中可能观察到的现象是: 。
发生反应的方程式为: 。
2.待乙中观察到明显现象后立即关闭活塞b,并打开活塞a,又将可能观察到的实验现象是: 。
. 某探究学习小组的同学学习氨的性质以后,为了探究氨气的某些性质,设计并进行了以下实验:
(Ⅰ)NH3的制取及收集
1.写出实验制取氨气的化学方程式 ;
2.收集氨气的方法是 。
(II)HCl的制取及收集
实验室通常以反应:2NaCl(晶体)+H2SO4(浓)![]() Na2SO4 + 2HCl↑ 为原理来制取少量HCl气体,试据此分析并回答下列问题:
Na2SO4 + 2HCl↑ 为原理来制取少量HCl气体,试据此分析并回答下列问题:
1.实验室制取HCl气体可选择下列装置中的
A.实验室制氧气的装置 B.实验室制氢气的装置
C.实验室制二氧化碳的装置 D.实验室制氯气的装置
(III)验证氨气部分性质的探究实验:
为了同时进行氨气溶于水以及氨气与HCl的反应的探究,同学们积极思考并设计了如下的实验装置图。首先在甲、乙两个干燥的圆底烧瓶中分别收集满了NH3和HCl气体,然后再按如下图所示连接好各个装置(活塞a和b均处于关闭状态),并按以下步骤进行实验:
[来源:学_科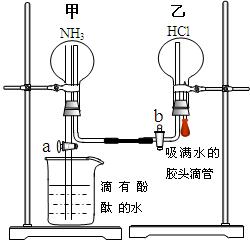
1.先挤压胶头滴管再打开活塞b,请你预测此时乙中可能观察到的现象是: 。
发生反应的方程式为: 。
2.待乙中观察到明显现象后立即关闭活塞b,并打开活塞a,又将可能观察到的实验现象是: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com