
题目列表(包括答案和解析)
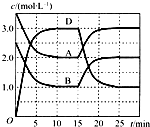 (2013?南通一模)温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g);△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示.下列说法正确的是( )
(2013?南通一模)温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g);△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示.下列说法正确的是( ) (2000?上海)化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米、淀粉等发酵制得.A的钙盐是人们喜爱的补钙剂之一,A在某种催化剂存在下进行氧化,其产物不能发生银镜反应.在浓硫酸存在下,A可发生如下反应.
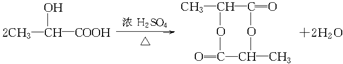
(2000?上海)化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米、淀粉等发酵制得.A的钙盐是人们喜爱的补钙剂之一,A在某种催化剂存在下进行氧化,其产物不能发生银镜反应.在浓硫酸存在下,A可发生如下反应.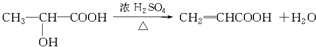


| ①镁、铝、锌都是银白色的金属 ②锌(Zn)可以与NaOH溶液反应生成H2 ③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3?H2O ④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸转化变成Zn2+、NH4+●提出假设: (1)假设①:该混合金属粉末中除镁外还含有 假设②:该混合金属粉末中除镁外还含有 假设③:该混合金属粉末中除镁外还含有铝、锌. ●实验探究: 甲同学基于假设③设计实验方案: 操作Ⅰ是在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,再加足量的稀氨水,请回答:  乙同学基于假设③设计另一方案:  (2)沉淀A、B、D的化学式:A (3)甲同学用样品和稀硫酸反应所得溶液含有较多H+、Mg2+、Al3+、SO42-,向其中滴入NaOH溶液,生成沉淀的量与加入NaOH溶液体积关系可能正确的是  (4)乙同学方案的操作②中,铝与NaOH溶液反应的化学方程式为 操作②与操作③中都加了NaOH溶液,但其用量差别是 (5)丙同学通过分析对比,认为乙的方案比甲同学的好,其理由可能是 短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为34,且原子的最外层电子数之和为10;A、C的原子最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素.下列叙述正确的是( ) A、B、C、D、E都是前20号元素中的常见元素,且核电荷数递增.A原子没有中子;B原子次外层电子数与最外层电子数之差等于电子层数;C元素是地壳中含量最高的元素;4.6g D单质与足量盐酸作用可产生2.24LH2(标准状态下);E的一价阴离子的核外电子排布与Ar的核外电子排布相同.请回答下列问题: (1)写出A、B、D的元素符号:A H H ;BC C ;DNa Na .(2)C离子的电子式 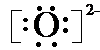 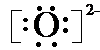 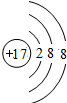  (3)实验室里检验E的单质常用的试剂是 淀粉KI溶液(或试纸) 淀粉KI溶液(或试纸) .(4)写出电解D、E形成化合物的水溶液的化学反应方程式 2NaCl+2H2O
2NaCl+2H2O .
(5)写出由A、B、C、D形成的化合物与由A、C、E形成的化合物发生反应的化学反应方程式 HClO4+NaHCO3=NaClO4+H2O+CO2↑ HClO4+NaHCO3=NaClO4+H2O+CO2↑ .同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |