
题目列表(包括答案和解析)
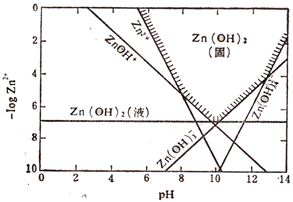 (2011?肇庆二模)请回答有关锌及其化合物的问题.
(2011?肇庆二模)请回答有关锌及其化合物的问题. Zn2+(aq)+2OH-(aq),而Ksp[Zn(OH)2]>Ksp(ZnS),滴入的S2-与Zn2+结合生成了更难溶(或溶度积更小)的ZnS,使Zn2+浓度减小,溶解平衡继续向右移动直至全部转化为ZnS
Zn2+(aq)+2OH-(aq),而Ksp[Zn(OH)2]>Ksp(ZnS),滴入的S2-与Zn2+结合生成了更难溶(或溶度积更小)的ZnS,使Zn2+浓度减小,溶解平衡继续向右移动直至全部转化为ZnS Zn2+(aq)+2OH-(aq),而Ksp[Zn(OH)2]>Ksp(ZnS),滴入的S2-与Zn2+结合生成了更难溶(或溶度积更小)的ZnS,使Zn2+浓度减小,溶解平衡继续向右移动直至全部转化为ZnS
Zn2+(aq)+2OH-(aq),而Ksp[Zn(OH)2]>Ksp(ZnS),滴入的S2-与Zn2+结合生成了更难溶(或溶度积更小)的ZnS,使Zn2+浓度减小,溶解平衡继续向右移动直至全部转化为ZnS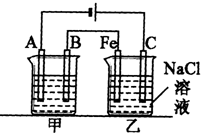

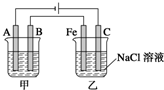 如图所示:甲、乙为相互串联的两电解池.试回答:
如图所示:甲、乙为相互串联的两电解池.试回答: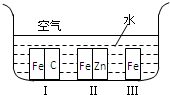 选考题[化学--选修化学与生活]
选考题[化学--选修化学与生活]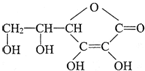 ,它的分子式是
,它的分子式是湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com