
题目列表(包括答案和解析)
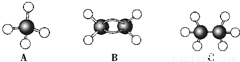
 填空 (1)现有A、B、C三种烃,其球棍模型如图:
填空 (1)现有A、B、C三种烃,其球棍模型如图: ;⑥
;⑥

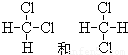 ;⑥
;⑥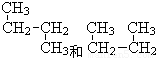
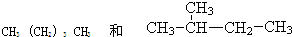
把足量的CO2通过0.2mol Na218O2,当完全反应后,碳酸钠的质量为
[ ]
| 温度(℃) | 10 | 20 | 30 | 40 | 70 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com