
题目列表(包括答案和解析)
用NA表示阿伏加德罗常数,下列叙述正确的是
A. 标准状况下,22.4L H2O 含有的分子数为NA
B. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C. 通常状况下,NA个CO2分子占有的体积为22.4L
D. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA
阿伏加德罗常数约为6.02×1023 mol-1,下列说法中一定正确的是( )
A.3.4gNH3含共价键的数目约为0.2×6.02×1023个
B.l L 0.5mol/L碳酸钠溶液中含有0.5×6.02×1023个CO32-
C.标准状况下,22.4 L SO2与11.2 L O2,混合充分反应,可得6.02×1023个SO3分子
D.6.4g Cu投入300 mL 10mol/L的浓硝酸中,充分反应后转移0.2×6.02×1023个电子
NA表示阿伏加德罗常数的值,则下列叙述正确的是 ( )
A.6.8g熔融的KHSO4中含有0.1NA个阳离子
B.1 L 0.5mol/L Na2CO3溶液中含有的CO32-数目为0.5NA
C.25℃时,1 L pH=13的NaOH溶液中约含有NA个氢氧根离子
D.标准状况下,一定量的铜与硝酸反应后生成22.4 L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于NA
阿伏加德罗常数约为6.02×1023 mol-1,下列说法中一定正确的是
A.3.4gNH3含共价键的数目约为0.2×6.02×1023个
B.l L 0.5mol/L碳酸钠溶液中含有0.5×6.02×1023个CO32-
C.标准状况下,22.4 L SO2与11.2 L O2,混合充分反应,可得6.02×1023个SO3分子
D.6.4g Cu投入300 mL 10mol/L的浓硝酸中,充分反应后转移0.2×6.02×1023个电子
A.欲测某溶液的pH,是用洁净、干燥的玻璃棒蘸取该溶液,点在干燥的pH试纸上,观察试纸的颜色,并与标准比色卡比较
B.将浓H2SO4和乙醇按体积比3:1混合,置于圆底烧瓶,加热,使温度迅速升高到
C.将饱和FeCl3溶液滴入蒸馏水中即得Fe(OH)3胶体
D.取1mol/L CuSO4溶液和0.5mol/LNaOH溶液各lmL,在一支洁净的试管内混合后,向其中又加入0.5mL40%乙醛加热至沸,将产生红色沉淀
E.定性检验C2H5Br中的溴元素,将C2H5Br和NaOH溶液混合加热后,加硫酸酸化
F.向苯酚溶液中滴加少量浓溴水,振荡,无现象
(2)请用图2-4所示的仪器装置,设计一个电解饱和MgCl2溶液,来测定电解时产生的氢气的体积,并检验氯气的氧化性。
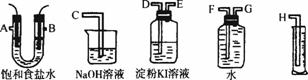
图2-4
①所选仪器连接时各接口的顺序是(填各接口的代号字母):
A接_______、________接_______;B接________、________接________。
②实验时,装置中的石墨电极接电源的____________极,所发生的反应为__________________,铁电极接电源的____________极,所发生的反应为____________,此电解总反应方程式为________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com