
题目列表(包括答案和解析)
亚硝酰氯(NOCl)是有机物合成中的重要试剂,可由NO与Cl2在通常条件下反应得到。某研究性学习小组拟在实验室通风橱中制取亚硝酰氯,先查得如下资料:
①
| 分子式 | 别名 | 熔点 | 沸点 | 溶解性 | 性状 |
| NOCl | 氧化亚硝酰 | ―64.5℃ | ―5.5℃ | 溶于浓硫酸 | 红褐色液体或黄色有毒气体,具有刺激恶臭。遇水生成氮的氧化物与氯化氢 |
②2NO2+2NaOH=NaNO3+NaNO2+H2O
随后他们拟定了如下合成装置示意图
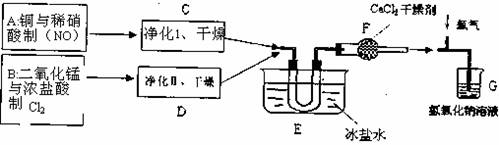
试回答下列问题:
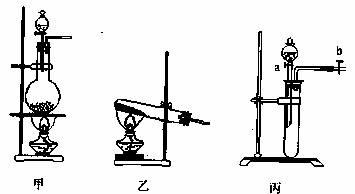
(1)写出制NO的离子方程式 ,装置应选 (从下图乙、丙中选),该装置在使用前,怎样检验其气密性(只有蒸馏水,不能再添加其他仪器或用品) 。
(2)画出净化装置I的装置图并标明所用试剂 。
(3)无水氯化钙的作用是 ;写出氯化亚硝酰与水反应的化学方程式 。
(4)在E装置中能看到的现象 。
(5)指导老师认为装置G不能有效除去有毒气体,写出你的见解和改进措施
化学在环境监测中越来越显示其重要作用,水体受还原性物质(主要是有机物)污染的程度常用化学需氧量(COD)来衡量。COD是指在一定条件下,用强氧化剂处理一定体积水样时所消耗的强氧化剂相当于氧气的质量,单位用mg/L表示。
重铬酸钾法是指在强酸性溶液中,用一定量的重铬酸钾氧化(以Ag+作催化剂)水样中的还原性物质,其本身被还原为Cr3+,过量的重铬酸钾以试亚铁灵作指示剂、用硫酸亚铁铵溶液回滴,根据相关试剂的用量即可求出水样的化学需氧量(COD)。
请回答下列问题:
(1)当水样中含有浓度较高的Cl-时,常需加入HgSO4溶液,则HgSO4的作用及可能原因是 。
(2)滴定时硫酸亚铁铵溶液需盛放在 (填“酸”或“碱”)式滴定管中。
(3)国家《生活饮用水标准检验法(GB5750-85)》中酚类的检测下限为0.002 mg/L。某水源受化工厂污染,酚含量达0.282 mg/L,该污染的水样中酚(以苯酚氧化成CO2计算)引起的化学需氧量(COD)为 mg/L。
(4)某化工园区有两家企业排放出的废水中,某次COD测量值高达2100 mg/L,这两家企业最有可能是 。(填字母)
a.制糖厂 b.水泥厂 c.电镀厂 d.造纸厂
(5)现有某废水样品10.00 mL,先加入10 mL蒸馏水,然后加入10.00 mL 0.04000 mol/L K2Cr2O7溶液、3 mL 1%硫酸-硫酸银溶液、17 mL硫酸汞溶液,加热反应2 h。在试亚铁灵指示剂存在下用0.1000 mol/L Fe(NH4)2(SO4)2溶液滴定多余的K2Cr2O7,共用去Fe(NH4)2(SO4)2溶液12.00 mL。试计算该水样的化学需氧量(COD)。
清洗和制绒是硅晶片制作的重要步骤之一,硅片化学清洗的主要目的是除去硅片表面杂质(如某些有机物,无机盐,金属、Si、SiO2粉尘等)。常用的化学清洗剂有高纯水、有机溶剂、双氧水、浓酸、强碱等。其中去除硅的氧化物,通常用一定浓度的HF溶液,室温条件下将硅片浸泡1至数分钟。制绒是在硅片表面形成金字塔形的绒面,增加硅对太阳光的吸收。单晶制绒通常用NaOH、Na2SiO3等混合溶液在75~90℃反应25~35 min,效果良好。回答下列问题
Ⅰ.(1)写出晶片制绒反应的离子方程式 ,对单晶制绒1990年化学家Seidel提出了一种的电化学模型,他指出Si与NaOH溶液的反应,首先是Si与OH一反应,生成SiO44一,然后SiO44一迅速水解生成H4SiO4。基于此原理分析反应中氧化剂为 。
(2)本校化学兴趣小组同学,为验证Seidel的理论是否正确,完成以下实验:
|
|
实验事实 |
|
事实一 |
水蒸汽在600℃时可使粉末状硅缓慢氧化并放出氢气。 |
|
事实二 |
盛放于铂或石英器皿中的纯水长时间对粉末状还原硅无腐蚀作用。 |
|
事实三 |
普通玻璃器皿中的水仅因含有从玻璃中溶出的微量的碱便可使粉末状硅在其中缓慢溶解。 |
|
事实四 |
在野外环境里,用较高百分比的硅铁粉与干燥的Ca(OH)2和NaOH,点着后焖烧,可剧烈放出H2。 |
|
事实五 |
1g(0.036mo1)Si和20mL含有lgNaOH(0.025mol)的溶液,小心加热(稍微预热),收集到约1700mL H2,很接近理论值(1600mL)。 |
结论:从实验上说明碱性水溶液条件下,H2O可作 剂;NaOH作_____ 剂,降低反应 。高温无水环境下,NaOH作 剂。
Ⅱ.在工业中利用镁制取硅:2Mg+SiO2 2MgO+Si,同时有副反应发生:2Mg+Si
2MgO+Si,同时有副反应发生:2Mg+Si Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体。如图是进行Mg与SiO2反应的实验装置:
Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体。如图是进行Mg与SiO2反应的实验装置:

由于氧气的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。 a.石灰石 b.锌粒 c.纯碱
(4)实验开始时,必须先通入X气体,再加热反应物,其理由是______________________________,当反应开始后,移走酒精灯反应能继续进行,其原因是___________________________。
(5)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸。可观察到闪亮的火星,产生此现象的原因用化学方程式表示为_______________________________________。
清洗和制绒是硅晶片制作的重要步骤之一,硅片化学清洗的主要目的是除去硅片表面杂质(如某些有机物,无机盐,金属、Si、SiO2粉尘等)。常用的化学清洗剂有高纯水、有机溶剂、双氧水、浓酸、强碱等。其中去除硅的氧化物,通常用一定浓度的HF溶液,室温条件下将硅片浸泡1至数分钟。制绒是在硅片表面形成金字塔形的绒面,增加硅对太阳光的吸收。单晶制绒通常用NaOH,Na2SiO3等混合溶液在75~90℃反应25~35 min,效果良好。
回答下列问题
(1)能否用玻璃试剂瓶来盛HF溶液,为什么?用化学方程式加以解释 ;
(2)写出晶片制绒反应的离子方程式 ,对单晶制绒1990年化学家Seidel提出了一种的电化学模型,他指出Si与NaOH溶液的反应,首先是Si与OH一反应,生成SiO44一,然后SiO44一迅速水解生成H4SiO4。基于此原理分析反应中氧化剂为 。
(3)本校化学兴趣小组同学,为验证Seidel的理论是否正确,完成以下实验:
|
|
实验事实 |
|
事实一 |
水蒸汽在600℃时可使粉末状硅缓慢氧化并放出氢气。 |
|
事实二 |
盛放于铂或石英器皿中的纯水长时间对粉末状还原硅无腐蚀作用。 |
|
事实三 |
普通玻璃器皿中的水仅因含有从玻璃中溶出的微量的碱便可使粉末状硅在其中缓慢溶解。 |
|
事实四 |
在野外环境里,用较高百分比的硅铁粉与干燥的Ca(OH)2和NaOH,点着后焖烧,可剧烈放出H2。 |
|
事实五 |
1g(0.036mo1)Si和20mL含有lgNaOH(0.025mol)的溶液,小心加热(稍微预热),收集到约1700mL H2,很接近理论值(1600mL)。 |
结论:从实验上说明碱性水溶液条件下,H2O可作 剂;NaOH作 剂,降低反应 。高温无水环境下,NaOH作 剂。
(4)在太阳能电池表面沉积深蓝色减反膜——氮化硅晶膜。常用硅烷(SiH4)与氨气(NH3)在等离子体中反应。硅烷是一种无色、有毒气体,常温下与空气和水剧烈反应。下列关于硅烷、氮化硅的叙述不正确的是 。
A.在使用硅烷时要注意隔离空气和水,SiH4能与水发生氧化还原反应生成H2;
B.硅烷与氨气反应的化学方程式为:3SiH4+4NH3=Si3N4+12H2↑,反应中NH3作氧化剂;
C.它们具有卓越的抗氧化、绝缘性能和隔绝性能,化学稳定性很好,不与任何酸、碱反应;
D.氮化硅晶体中只存在共价键,Si3N4是优良的新型无机非金属材料。
清洗和制绒是硅晶片制作的重要步骤之一,硅片化学清洗的主要目的是除去硅片表面杂质(如某些有机物,无机盐,金属、Si、SiO2粉尘等)。常用的化学清洗剂有高纯水、有机溶剂、双氧水、浓酸、强碱等。其中去除硅的氧化物,通常用一定浓度的HF溶液,室温条件下将硅片浸泡1至数分钟。制绒是在硅片表面形成金字塔形的绒面,增加硅对太阳光的吸收。单晶制绒通常用NaOH,Na2SiO3等混合溶液在75~90℃反应25~35 min,效果良好。
回答下列问题
(1)能否用玻璃试剂瓶来盛HF溶液,为什么?用化学方程式加以解释 ;
(2)写出晶片制绒反应的离子方程式 ,对单晶制绒1990年化学家Seidel提出了一种的电化学模型,他指出Si与NaOH溶液的反应,首先是Si与OH一反应,生成SiO44一,然后SiO44一迅速水解生成H4SiO4。基于此原理分析反应中氧化剂为 。
(3)本校化学兴趣小组同学,为验证Seidel的理论是否正确,完成以下实验:
| | 实验事实 |
| 事实一 | 水蒸汽在600℃时可使粉末状硅缓慢氧化并放出氢气。 |
| 事实二 | 盛放于铂或石英器皿中的纯水长时间对粉末状还原硅无腐蚀作用。 |
| 事实三 | 普通玻璃器皿中的水仅因含有从玻璃中溶出的微量的碱便可使粉末状硅在其中缓慢溶解。 |
| 事实四 | 在野外环境里,用较高百分比的硅铁粉与干燥的Ca(OH)2和NaOH,点着后焖烧,可剧烈放出H2。 |
| 事实五 | 1g(0.036mo1)Si和20mL含有lgNaOH(0.025mol)的溶液,小心加热(稍微预热),收集到约1700mL H2,很接近理论值(1600mL)。 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com