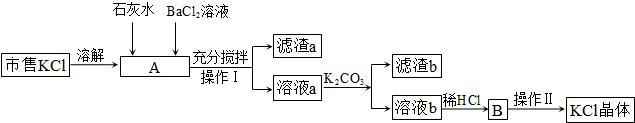
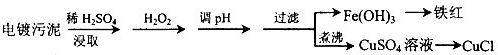(2013?烟台一模)某工厂的电镀污泥中含有铜、铁等金属化合物.为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
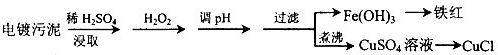
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀的PH |
2.3 |
7.6 |
4.4 |
| 完全沉淀的PH |
3.2 |
9.7 |
6.4 |
(1)酸浸后加入H
2O
2的目的是
将Fe2+氧化成Fe3+.便于调整PH值与Cu2+分离
将Fe2+氧化成Fe3+.便于调整PH值与Cu2+分离
.调pH步骤中加入的试剂最好是
CuO、或Cu(OH)2、或CuCO3
CuO、或Cu(OH)2、或CuCO3
(填化学式).实验室进行过滤操作所用到的玻璃仪器有
漏斗、烧杯、玻璃棒
漏斗、烧杯、玻璃棒
.
(2)煮沸CuSO
4溶液的原因是
除净溶液中的H2O2,避免影响下一步CuCl的生成
除净溶液中的H2O2,避免影响下一步CuCl的生成
.向CuSO
4溶液中加入一定量的NaCl、Na
2SO
3,可以生成白色的CuCl沉淀,写出该反应的化学方程式
2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4
2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4
.
(3)CuCl产品中CuCl的质量分数大于96.50%为国家合格标准.称取所制备的CuCl样品0.2500g置于一定量的0.5mol?L
-1FeCl
3溶液中,待样品完全溶解后,加水20mL,用0.1000mol?L
-1的Ce(SO
4)
2溶液滴定,到达终点时消耗Ce(SO
4)
2溶液24.60mL.有关的化学反应为:Fe
3++CuCl=Fe
2++Cu
2++Cl
-,Ce
4++Fe
2+=Fe
3++Ce
3+.通过计算说明该CuCl样品
符合
符合
(填“符合”或“不符合”)国家标准.
(4)25℃时,K
SP[Fe(OH)
3]=4.0×10
-38.Fe
3+发生水解反应Fe
3++3H
2O?Fe(OH)
3+3H
+,该反应的平衡常数为
2.5×10-5
2.5×10-5
.