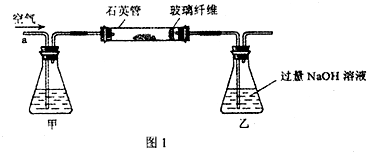
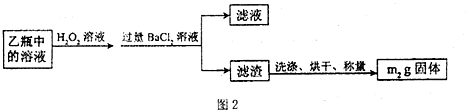
糖尿病是由于人体内胰岛素紊乱导致的代谢紊化综合症,以高血糖为主要标志.长期摄入高热量食品和缺少运动,都会导致糖尿病.
(1)血糖是指血液中的葡萄糖,下列有关说法正确的是
BC
BC
A.葡萄糖分子可表示为Ca(H
2O)
6,则每个葡萄糖分子含有6个H
2O
B.葡萄糖与果糖互为同分异构体
C.糖尿病人尿糖较高,可用新制的氢氧化铜来检测病人尿液中的葡萄糖
D.淀粉水解的最终产物是氨基酸
(2)木糖醇 结构简式为:CH
2OH(CHOH)
3CH
2OH是一种甜味剂,糖尿病人食用后不会导致血糖升高.若用氯原子取代木糖醇分子中碳原子上的氢原子,得到的一氯代物有
3
3
种同分异构体.
(3)糖尿病人不可饮酒,酒精在肝脏内可转化成有机物A.A的实验结果如下:
①通过实验测得A的相对分子质量为60.
②A由C、H、O三种元素组成,分子中只存在两种类型的氢原子,且这两种类型的氢原子的个数比为1:3.
③A可与酒精在一定条件下生成有芳香气味的物质.
请设计实验证明A与碳酸的酸性强弱:向A溶液中加入
碳酸钠
碳酸钠
溶液,发现有气泡冒出;写出A与酒精反应的化学方程式
CH
3COOH+CH
3CH
2O
CH
3COOCH
2CH
3+H
2O
CH
3COOH+CH
3CH
2O
CH
3COOCH
2CH
3+H
2O
.
(4)糖尿病人宜多吃蔬菜和豆类食品,豆类食品中富有蛋白质.下列说法正确的是
BD
BD
.
A.蛋白质溶液遇碘单质会变蓝色
B.蛋白质可以通过烧焦时的特殊气味鉴别
C.人体内不含水解纤维素的酶,不能消化纤维素,因此蔬菜中的纤维素对人体没有用处
D.部分蛋白质溶液遇浓硝酸变黄,称为蛋白质的显色反应
E.工业上常利用蛋白质的皂化反应来制取肥皂.