
题目列表(包括答案和解析)
过氧化氢在催化剂作用下可快速产生氧气,它不仅是常用的消毒剂,还在航天和军事工业上有重要的用途。
(1)写出在过氧化氢溶液中加入MnO2粉末时,反应的化学方程式 。
(2)常用的消毒剂CH3COOOH(过氧乙酸),可以用冰醋酸和过氧化氢反应制取。制取时的化学反应方程式为 。该消毒剂中含有的少量过氧化氢,可以用它与高锰酸钾、次氯酸钠等强氧化剂的反应进行测定。请问,该消毒剂能否与漂粉精混合使用。
(3)过氧化氢和强还原剂液态肼(N2H4)可构成火箭推进剂。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 rnol液态肼与足量的过氧化氢反应,生成氮气和水蒸气,放出236.64kJ的热量。
①写出该反应的热化学方程式 。
②又知H2O(l)=H2O(g);![]() 44 kJ?mol
44 kJ?mol![]() ,则16 g液态肼与过氧化氢反应生成液态水时放出的热量是 kJ。
,则16 g液态肼与过氧化氢反应生成液态水时放出的热量是 kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有―个很大的优点是
| 光 |
| ||
| ||

| ||
| ||
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+ 2H2(g) CH3OH(g)
CH3OH(g)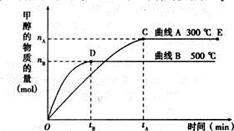
根据题意完成下列各题:
(1)5000C,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)= (用nB、 tB 表示)
(2)在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的1/2,下列有关该体系的说法正确的是
a .氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(3)可逆反应:CO(g)+ 2H2(g) CH3OH(g) 在恒容密闭容器中反应,达到平衡状态的标志是:
CH3OH(g) 在恒容密闭容器中反应,达到平衡状态的标志是:
①单位时间内生成2n molH2的同时生成n mol CH3OH
②单位时间内生成2n molH2的同时,生成n mol CO
③用CO、H2、CH3OH 的物质的量浓度变化表示的反应速率的比为1 : 2 : 1的状态
④混 合气体的密度不再改变的状态
⑤ 混合气体的平均相对分子质量不再改变的状态
(4)改变下列哪些条件能增大甲醇的产量( )
| A.增大容器体积 | B.增大压强 | C.升高温度 | D.加催化剂 |
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+ 2H2(g) CH3OH(g)
CH3OH(g)
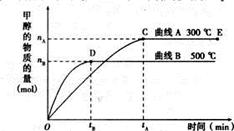
根据题意完成下列各题:
(1)5000C,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)= (用nB、 tB 表示)
(2)在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的1/2,下列有关该体系的说法正确的是
a .氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(3)可逆反应:CO(g)+ 2H2(g) CH3OH(g) 在恒容密闭容器中反应,达到平衡状态的标志是:
CH3OH(g) 在恒容密闭容器中反应,达到平衡状态的标志是:
①单位时间内生成2n molH2的同时生成n mol CH3OH
②单位时间内生成2n molH2的同时,生成n mol CO
③用CO、H2、CH3OH 的物质的量浓度变化表示的反应速率的比为1 : 2 : 1的状态
④混 合气体的密度不再改变的状态
⑤ 混合气体的平均相对分子质量不再改变的状态
(4)改变下列哪些条件能增大甲醇的产量( )
A.增大容器体积 B.增大压强 C.升高温度 D.加催化剂
(5)反应达到平衡后再升高温度,K值 (填“增大”“减小”或“不变”)。
(6)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
 CH3OH(g)
CH3OH(g)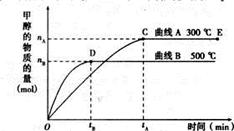
 CH3OH(g) 在恒容密闭容器中反应,达到平衡状态的标志是:
CH3OH(g) 在恒容密闭容器中反应,达到平衡状态的标志是: | A.增大容器体积 | B.增大压强 | C.升高温度 | D.加催化剂 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com