
题目列表(包括答案和解析)
| 7 | 8 |
PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx
(1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。
①已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ∆H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) ∆H = -566.0 kJ/mol
H2O(g)=H2O(1) ∆H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________。
②以甲醇和氧气反应制成的燃料电池如图所示,该电池工作过程中O2应从______(填“c”或“b”)口通入,电池负极反应式为__________________。

③25℃时,将甲醇燃烧生成的足量CO2通入到浓度为0.lmol·L-1,NaOH溶液中,所得溶液的pH=8,溶液中离子浓度由大到小的顺序是_________________。
(2)已知在一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)=N2O3(g),ΔH<0若该反应在绝热、恒容的密闭体系中进行,下列示意图能说明tl时刻达到平衡状态的是____________。

(3)在一个固定容积为5L的密闭容器中充入0.20molSO2和0.l0molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=__________,若继续通入0.20mo1SO2和0.lmolO2,则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(4)在一定条件下,NO2可以被NH3还原为N2来消除NO2对环境造成的污染。25℃时,将NH3溶于水得l00mL 0.lmol·L-的氨水,测得pH=11,则该条件下NH3·H2O的电离平衡常数约为___________。
 。H2是合成氨的原料,
。H2是合成氨的原料,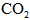 供合成尿素用。若从充分利用原料的角度考虑,选用________(填序号)物质作原料较好.
供合成尿素用。若从充分利用原料的角度考虑,选用________(填序号)物质作原料较好. 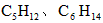 ) C.
) C. D.焦炭
D.焦炭  水解生成BiOCl沉淀.试回答下列问题:
水解生成BiOCl沉淀.试回答下列问题: 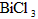 分解的反应方程式为____________________________________.
分解的反应方程式为____________________________________. 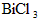 溶于浓NaCl溶液中或溶于含有少量盐酸的水中都得到澄清溶液,试用平衡移动原理分析可能的原因____________________________________.
溶于浓NaCl溶液中或溶于含有少量盐酸的水中都得到澄清溶液,试用平衡移动原理分析可能的原因____________________________________. 若某同系列的有机物通式为CnHn,它们都有多种同分异构体,C4H4为其中最简单的一种,按要求填空:
(1) 若C4H4为链状结构,可把它看作是由两个乙炔分子加成得到的,其结构简式为 ▲ ;
如果在一定条件下使它与H2充分加成,所生成物质的同分异构体的名称是 ▲ 。
(2) 若C4H4为平面环状结构,与Br2按物质的量之比1︰1加成,加成的产物只有一种,则其结构简式为 ▲ ;
(3) 若C4H4为正四面体结构,C8H8为正六面体结构,它们每个碳原子分别与三个碳原子通过单键相连,则符合上述结构的C4H4和C8H8的二元取代物分别有 ▲ 、 ▲ 种。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com