
题目列表(包括答案和解析)
I.完成下列离子方程式(给出物质的计量数不能改变)
(1) +6H+=2Fe3++3
(2) +Ca2++2 =CaCO3↓+
II.常温下有浓度均为0.5mol/L的五种溶液:①NaHCO3;②C6H5ONa;③ NH4HCO3;④ NH3.H2O;⑤ HCl
(1)上述五种溶液中既能跟盐酸反应又能跟NaOH溶液反应的是 (填序号)。
(2)上述②的水溶液呈碱性的原因是(用离子方程式表示) 。
(3)③跟足量的NaOH浓溶液在加热条件下反应的离子方程式是
.
(4)加热④,溶液中的c(OH-)的变化有甲乙两种猜想,请设计实验探究证明
甲:c(OH-)将增大。升高温度有利于电离平衡移动,使氨水中c(OH-)增大。
乙:c(OH-)将减小。受热时温度升高氨气逸出,使c(OH-)减小
实验设计:
.
(5)取10mL溶液加水稀释到500mL,则该溶液中由水电离出的c(H+)=
mol/L. ![]()
物质A有如下图所示转化关系,其中乙为金属单质,常温下,它在G的浓溶液中发生钝化,F的溶液中只含有一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明).请讨论以下两种情况(注:两种情况下各字母代表的物质可能不同)
回答下列问题:
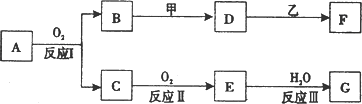
(1)第一种情况:用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质;D和F的溶液均呈碱性.则:
①反应Ⅲ的化学方程式为________.
②D与乙反应的离子方程式为________
(2)第二种情况:甲由两种单质直接化合得到;B为红棕色固体;C为无色气体,是形成酸雨的大气污染物之一;D的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成.则:
①工业上,反应I的化学方程式为________
生产设备名称为:________
②D和乙反应的离子方程式为________
③请简述检验D溶液中阳离子的方法________.
④若A的相对分子质量为120,反应Ⅰ、Ⅱ、Ⅲ均为完全转化.现取m克含A及少量杂质的样品,按上述过程充分反应后(杂质不参与反应),得到密度为ρ g/cm3,溶质质量分数为a%的G溶液n mL.则该样品中A的质量分数=________(列出计算式即可).

| ||
| ||
| △ |
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com