
题目列表(包括答案和解析)
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ/mol,甲醚可作燃料电池的燃料。工业上用合成气(CO、H2)直接或间接制取甲醚。
(1)写出甲醚燃烧的热化学方程式 。
|
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极
可构成燃料电池。该电池的负极反应式为
;
从能量角度分析甲醚用作燃料电池与直接燃烧相比
主要的优点是 。
(4)用(3)中的燃料电池为电源,以石墨为电极电解
500 mL滴有酚酞的:NaCl溶液,装置如图所示:
①请写出电解过程中Y电极附近观察到的现象
。
②当燃料电池消耗2.8 LO2(标准状况下)时,计算
此时:NaCl溶液的pH= (假设溶液的体积不变,气体全部从溶液中逸出)。
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ/mol,甲醚可作燃料电池的燃料。工业上用合成气(CO、H2)直接或间接制取甲醚。
(1)写出甲醚燃烧的热化学方程式 。
|
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极
可构成燃料电池。该电池的负极反应式为
;
从能量角度分析甲醚用作燃料电池与直接燃烧相比
主要的优点是 。
(4)用(3)中的燃料电池为电源,以石墨为电极电解
500 mL滴有酚酞的:NaCl溶液,装置如图所示:
①请写出电解过程中Y电极附近观察到的现象
。
②当燃料电池消耗2.8 LO2(标准状况下)时,计算
此时:NaCl溶液的pH= (假设溶液的体积不变,气体全部从溶液中逸出)。
(8分)碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
(1)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式: 。
(2)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇。已知H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。则:
①用太阳能分解10mol水消耗的能量是_____________kJ;
②甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_______ ____ 。
(3)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H=+489.0 kJ·mol-1
CO(g)+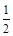 O2(g) =CO2(g),△H=-283.0 kJ·mol-1
O2(g) =CO2(g),△H=-283.0 kJ·mol-1
C(石墨)+O2(g) =CO2(g),△H=-393.5 kJ·mol-1
则4Fe(s)+3O2(g) =2Fe2O3(s),△H= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com