
题目列表(包括答案和解析)
 CH3COOH+OH- ,使得溶液中的c(OH-)>c(H+)
CH3COOH+OH- ,使得溶液中的c(OH-)>c(H+) 下列叙述中不正确的是 ( )
A.一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是发生了如下反应:
CH3COO-+H2O ![]() CH3COOH+OH-使得溶液中的c(OH-)>c(H+)
CH3COOH+OH-使得溶液中的c(OH-)>c(H+)
B.在0.1mol/LNa2CO3溶液中:2c(Na+)=c(H2CO3)+c(CO2-3)+c(HCO3-)
C.在0.1mol/LNH4Cl溶液中:c(H+)+c(NH4+)=c(Cl-)+c(OH-)
D.将0.2mol/L的盐酸与0.1mol/L的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(H+)<c(Al3+)<c(Na+)<c(Cl-)
|
下列叙述中不正确的是 | |
| [ ] | |
A. |
一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是发生了如下反应: CH3COO-+H2O |
B. |
在0.1 mol/L Na2CO3溶液中:2c(Na+)=c(H2CO3)+c(CO32-)+c(HCO3-) |
C. |
在0.1 mol/L NH4Cl溶液中:c(H+)+c(NH4+)=c(Cl-)+c(OH-) |
D. |
将0.2 mol/L的盐酸与0.1 mol/L的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(H+)<c(Al3+)<c(Na+)<c(Cl-) |
下列对各种平衡体系的叙述中,不正确的是
A.一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是溶液中存在如下平衡:
CH3COO- +H2O CH3COOH+OH-,使得溶液中的c(OH-)>c(H+)
CH3COOH+OH-,使得溶液中的c(OH-)>c(H+)
B某温度下,容积一定的密闭容器中进行可逆反应,X(g) +Y(g) 2Z(g)+W(s)
2Z(g)+W(s) 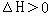 平衡后,升高温度,c(Z)增大
平衡后,升高温度,c(Z)增大
C.常温下,在醋酸溶液中加入少量的CH3COONa固体,会使其电离平衡正向移动
D.在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡向溶解的方向移动
下列对各种平衡体系的叙述中,不正确的是
A.一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是溶液中存在如下平衡:
CH3COO- +H2O CH3COOH+OH-,使得溶液中的c(OH-)>c(H+)
CH3COOH+OH-,使得溶液中的c(OH-)>c(H+)
B某温度下,容积一定的密闭容器中进行可逆反应,X(g)
+Y(g) 2Z(g)+W(s)
2Z(g)+W(s)  平衡后,升高温度,c(Z)增大
平衡后,升高温度,c(Z)增大
C.常温下,在醋酸溶液中加入少量的CH3COONa固体,会使其电离平衡正向移动
D.在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡向溶解的方向移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com