
题目列表(包括答案和解析)
下列说法不正确的是( )
A.0.2mol·L-1的NaHCO3溶液中:c ( Na+ ) > c ( HCO3— ) > c( OH— ) >c ( H+ )
B.将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸需加入的水多
C.向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c ( NH4+ ) = c ( Cl— )
D.浓度相同的NaOH溶液与醋酸溶液等体积混合后所得溶液的pH=7
下列说法不正确的是 ( )
A.0.2mol·L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+)
B.将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多
C.向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+)= c(Cl-)
D.pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7
 (2013?临沂三模)工业上“固定”和利用CO2能有效地减轻“温室效应”.
(2013?临沂三模)工业上“固定”和利用CO2能有效地减轻“温室效应”.| 物质的化学式 | CH3COOH | H2CO3 | |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
| c(CH3COO-) |
| c(CH3COOH) |
| 物质的化学式 | CH3COOH | H2CO3 | |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
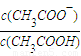 =______.
=______.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com