
题目列表(包括答案和解析)
|
下列各组离子能大量共存,当溶液中c(H+)=10-1 mol/L时,有气体产生;而当溶液中c(H+)=10-13 mol/L时,又能生成沉淀.试组离子可能是 | |
A. |
Na+、Cu2+、NO3-、CO32- |
B. |
Ba2+、K+、Cl-、HCO3- |
C. |
Fe2+、Na+、SO42-、NO3- |
D. |
Mg2+、NH4+、SO42-、Cl- |
下列说法正确的是( )
A.某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系可能为c(Cl-)>c(NH4+)>c(OH一)c(H+)
B.常温下0.1 mol/L的下列溶液①NH4Al(SO4)2②NH4Cl③NH3·H2O④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③
C.0.1 mol·L HA(一元酸)溶液与0.1 mol·L-1的NaOH溶液等体积混合:
c(H+)+c(Na+) c(OH一)+c(A-)
D.常温下0.4mol/L HA溶液和0.2mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子C浓度的大小顺序为:c(A一)>c(H+)>c(Na+)>c(OH一)
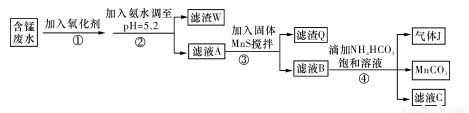
I.利用含锰废水(主要含Mn2+、SO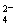 、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下:
、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下:
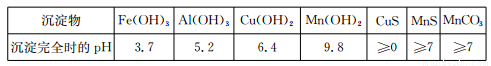
已知某些物质完全沉淀的pH如下表:
回答下列问题:
(1)过程②中,所得滤渣的主要成分是???????????????????????????? 。
(2)过程③中,发生反应的离子方程式是????????????????????????????????????? 。
(3)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3的反应的离子方程式是????????????????????????????????????????????????????????????????????????????? 。
(4)由MnCO3可制得重要的催化剂MnO2:2MnCO3+O2=2MnO2+2CO2。
现在空气中加热460.0 g MnCO3,得到332.0 g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是??????????? (用百分数表示,小数点后保留1位)。
Ⅱ.常温下,浓度均为0.1 mol/L的下列六种溶液的pH如下表:
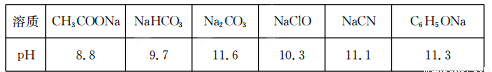
(1)上述盐溶液中的阴离子,结合H+能力最强的是????????????????????? 。
(2)根据表中数据判断,浓度均为0.0l mol/L的下列物质的溶液中,酸性最强的是
(填序号)。
A.HCN????? B.HC1O????? C.C6H5OH????? D.CH3 COOH??? E.H2 CO3
(3)据上表数据,请你判断下列反应不能成立的是???????? (填序号)。
A.HCN+ Na2 CO3=NaHCO3+NaCN
B.CH3 COOH+NaCN=CH3 COONa+HCN
C.CO2 +H2O+2C6 H5ONa=Na2 CO3 +2C6 H5OH
D.CH3 COONa+HClO=NaClO十CH3 COOH
将4molA和2mol B放入2 L密闭容器中发生反应2A(g)+B(g) 2C(g)△H<0 4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
2C(g)△H<0 4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
A.当c(A)︰c(B)︰c(C)=2︰1︰2时,该反应即达到平衡状态
B.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
C.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率增大,平衡常数增大
D.4 s内,v(B)=0.075 mol/(L·s)
下列说法正确的是( )
A.某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系可能为c(Cl-)>c(NH4+)>c(OH一)c(H+)
B.常温下0.1 mol/L的下列溶液①NH4Al(SO4)2②NH4Cl③NH3·H2O④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③
C.0.1 mol·L HA(一元酸)溶液与0.1 mol·L-1的NaOH溶液等体积混合:
c(H+)+c(Na+) c(OH一)+c(A-)
D.常温下0.4mol/L HA溶液和0.2mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子C浓度的大小顺序为:c(A一)>c(H+)>c(Na+)>c(OH一)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com