
题目列表(包括答案和解析)
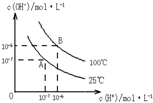 在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
在水的电离平衡中,c(H+)和c(OH-)的关系如图所示: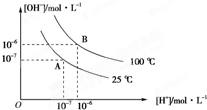 在水的电离平衡中,[H+]和[OH-]的关系如图所示:
在水的电离平衡中,[H+]和[OH-]的关系如图所示: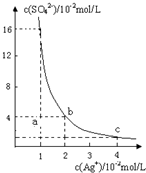 某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示:
某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示: A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
(2)将100 ℃时pH=8的Ba(OH)2溶液与pH=5的稀H2SO4混合,并保持100 ℃的恒温。欲使混合液的pH=7,则Ba(OH)2与稀H2SO4的体积比为_________(二者混合后体积假设为二者体积之和)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com