
题目列表(包括答案和解析)
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.1molCH3+含电子数为10NA
B.质量均为7.8 g Na2S、Na2O2的固体中含有的阴离子数均为0.1NA
C.标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中反应,转移的电子数均为0.1 NA
D.在反应S+2KNO3+3C K2S+N2↑+3CO2↑中,每生成1molN2转移的电子数为10NA
K2S+N2↑+3CO2↑中,每生成1molN2转移的电子数为10NA
设NA为阿伏伽德罗常数的值,下列叙述正确的是 ( )
A.1molCH![]() 含电子数为10NA
含电子数为10NA
B.质量均为7.8 g Na2S、Na2 O2的固体中含有的阴离子数均为0.1NA
C.2. 24LCl2通入足量H2O或NaOH溶液中反应,转移的电子数均为0.1 NA
D.在反应S+2KNO3+3C K2S+N2↑+3CO2↑中,每生成1molN2转移的电子数为10NA
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.1molCH3+含电子数为10NA
B.质量均为7.8 g Na2S、Na2O2的固体中含有的阴离子数均为0.1NA
C.标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中反应,转移的电子数均为0.1 NA
D.在反应S+2KNO3+3C![]() K2S+N2↑+3CO2↑中,每生成1molN2转移的电子数为10NA
K2S+N2↑+3CO2↑中,每生成1molN2转移的电子数为10NA
| 序号 | 分解水的过程 | 平衡常数 | T=2500K | T=3000K |
| A | H2O(g)?HO(g)+H(g) | K1 | 1.34×10-4 | 8.56×10-3 |
| B | HO(g)?H(g)+O(g) | K2 | 4.22×10-4 | 1.57×10-2 |
| C | 2H(g)?H2(g) | K3 | 1.52×103 | 3.79×10 |
| D | 2O(g)?O2(g) | K4 | 4.72×103 | 7.68×10 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
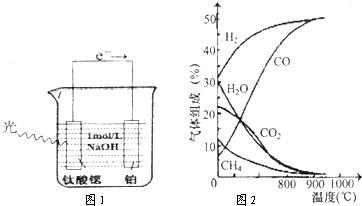
| ||
| ||

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com