
题目列表(包括答案和解析)
CaC2+2H2O→Ca(OH)2+CH≡CH↑
用反应产生的气体排水,测量排出水的体积,可计算出标准状况下乙炔的体积,从而测定电石中碳化钙的含量。
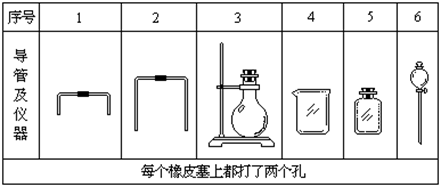
(1)用下图所列仪器和导管组装实验装置。
序号 | a | b | c |
导管及仪器 |
|
|
|
导管及仪器 |
|
|
|
每个橡皮塞上都打两个孔 | |||
如果所制气体的流向是从左向右的,上述仪器和导管从左到右直接连接的顺序是_______接________接_________接__________接__________接_________。
(2)仪器连接好后,进行实验,有下列操作(每项操作只进行一次)。
①在仪器f中注入适量水。
②称取一定量电石,置于仪器c中,塞紧橡皮塞。
③检查装置的气密性。
④待仪器c恢复到室温时,读取仪器d中水的体积(导管中的水忽略不计)。
⑤慢慢开启仪器f的塞,使水逐滴滴下,直至不产生气体时,关闭活塞。
正确的操作顺序是(填序号)________。
(3)实验中产生的气体常有难闻的气体,这可能是因为制得的乙炔气体中含有H2S、PH3等杂质。这些杂质的存在会使测得结果______。(填“偏大”“偏小”或“没有影响”)
(4)若实验时称取的电石为1.60g,测得排出水的体积,折算成标准状况下,乙炔的体积为448mL,则此电石中碳化钙的质量分数为________。
(14分)实验室常用邻苯二甲酸氢钾(KHC8H4O4)来标定氢氧化钠溶液的浓度,反应如下:KHC8H4O4+NaOH=KNaC8H4O4+H2O。邻苯二甲酸氢钾溶液呈酸性,滴定到达终点时,溶液的pH约为9.1。
(1)为标定NaOH溶液的浓度,准确称取一定质量的邻苯二甲酸氢钾(KHC8H4O4)加入250mL锥形瓶中,加入适量蒸馏水溶解,应选用_____________作指示剂,到达终点时溶液由______色变为_______色,且半分钟不褪色。(提示:指示剂变色范围与滴定终点pH越接近误差越小。)
(2)在测定NaOH溶液浓度时,有下列操作:①向溶液中加入1~2滴指示剂; ②向锥形瓶中加20mL~30mL蒸馏水溶解; ③用NaOH溶液滴定到终点,半分钟不褪色;④重复以上操作; ⑤准确称量0.4000g ~ 0.6000g邻苯二甲酸氢钾加入250mL锥形瓶中; ⑥根据两次实验数据计算NaOH的物质的量浓度。
以上各步操作中,正确的操作顺序是________________________________。
(3)上述操作中,将邻苯二甲酸氢钾直接放在锥形瓶中溶解,对实验是否有影响?
______________。(填“有影响”或“无影响”)
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的NaOH溶液滴定,此操作使实验结果____________。(填“偏大”“偏小”或“无影响”)
(5)现准确称取KHC8H4O4(相对分子质量为204.2)晶体两份各为0.5105g,分别溶于水后加入指示剂,用NaOH溶液滴定至终点,消耗NaOH溶液体积平均为20.00mL,则NaOH溶液的物质的量浓度为___________。(结果保留四位有效数字)
实验室常用邻苯二甲酸氢钾(KHC8H4O4)来标定氢氧化钠溶液的浓度,反应如
下:KHC8H4O4+NaOH=KNaC8H4O4+H2O。邻苯二甲酸氢钾溶液呈酸性,滴定到达终点时,溶
液的pH约为9.1。
(1)为标定NaOH溶液的浓度,准确称取一定质量的邻苯二甲酸氢钾(KHC8H4O4)加入
250mL锥形瓶中,加入适量蒸馏水溶解,应选用_____________作指示剂,到达
终点时溶液由______色变为_______色,且半分钟不褪色。![]() (提示:指示剂变色
(提示:指示剂变色
范围与滴定终点pH越接近误差越小。)
(2)在测定NaOH溶液浓度时,有下列操作:①向溶液中加入1~2滴指示剂; ②向
锥形瓶中加20mL~30mL蒸馏水溶解; ③用NaOH溶液滴定到终点,半分钟不褪
色;④重复以上操作; ⑤准确称量0.4000g ~ 0.6000g邻![]() 苯二甲酸氢钾加入
苯二甲酸氢钾加入
250mL锥形瓶中; ⑥根据两次实验数据计算NaOH的物质的量浓度。
以上各步操作中,正确的操作顺序是________________________________。
(3)上述操作中,将邻苯二甲酸氢钾直接放在锥形瓶中溶解,对实验是否有影响?
_____________。(填“有影响”或![]() “无影响”)
“无影响”)
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的NaOH溶液滴定,此操作使
实验结果____________。(填“偏大”“偏小”或“无影响”)
(5)现准确称取KHC8H4O4(相对分子质量为204.2)晶体两份各为0.5105g,分别溶[
于水后加入指示剂,用NaOH溶液滴定至终点,消耗NaOH溶液体积平均为[来源:Z_xx_k.Com]
20.00mL,则NaOH溶液的物质的量浓度![]() 为________。(结果保留四位有效数字)
为________。(结果保留四位有效数字)
用18 mol / L的硫酸溶液配制500 mL 1 mol / L的硫酸溶液,有下列操作步骤:
(1)将溶解后的硫酸溶液立即沿玻璃棒转入容量瓶中;
(2)将量得浓硫酸倒入烧杯中,加水溶解,然后用蒸馏水洗涤量筒2~3次倒入烧杯中;
(3)盖上瓶塞,轻轻摇匀即配制完毕。
(4)洗涤烧杯和玻璃棒2~3次,将洗涤液全部转入容量瓶中,加水至离刻度1~2 cm处,改用胶头滴管加水至刻度线;
(5)用量筒量取27.78 mL的浓硫酸。
先将以上步骤按实际操作的先后顺序排列,________________指出操作中所有的错误和不妥之处。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com