
题目列表(包括答案和解析)
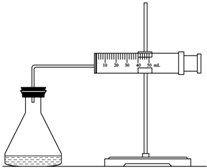 实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.
实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.| 实验编号 试剂 |
A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/mL | 0 | 5.0 | 10.0 |
| H2O/mL | V3 | V4 | 0 |
A.《物质结构与性质》模块(12分)
二茂铁【(C5H5)2 Fe】是由一个二价铁离子和2个环戊烯基负离子构成,它的发现可以说是有机金属化合物研究中具有里程碑意义的事件,它开辟了金属有机化合物研究的新领域,促进了金属有机化学的发展。二茂铁可以用还原铁粉与环戊二烯在氮气氛围中发生反应而制得:
2C5H6+Fe(还原铁粉)![]() (C5H5)2 Fe+H2。
(C5H5)2 Fe+H2。
请回答下列问题:
(1)写出二价铁离子的基态电子排布式: ;
(2)二茂铁的熔点是173℃(在100℃时开始升华),沸点是249℃,不溶于水,易溶于苯、乙醚等非极性溶剂。据此可推断二茂铁晶体为 晶体,由此可进一步推知,在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是 ;
(3)环戊二烯的结构式为: (图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),
(图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),![]() 是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;
是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;
(4)原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与N2分子互为等电子体的二价阴离子是 (填化学式),其电子式是 。
B.《实验化学》模块(12分)
(12分)某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,在教师指导下设计了如下方案:
称取1.0g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应生成沉淀的离子),Cl―即被全部沉淀。然后用含Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度。请回答下列问题:
(1)滴定反应达到终点的现象是: 。
(2)实施滴定的溶液以呈 (选填“酸性”、“中性”或“碱性”)为佳,加入 (填化学式)试剂可达这一目的。
(3)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n (Clˉ)的测定结果 (选填“偏高”、“偏低”或“无影响”)。
(4)到达终点后,则必须轻轻摇动锥形瓶,(此时不得剧烈摇动)以减少误差,否则这种误差会使n (Clˉ)测定值偏低,这说明两者的溶解度:AgCl AgSCN
(填“>”或“<”)。
(5)若以Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3时,用去上述浓度的NH4SCN溶液20.0mL,则原氯化锶样品的纯度为 。
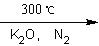 (C5H5)2 Fe+H2。
(C5H5)2 Fe+H2。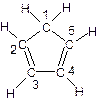 (图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),
(图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),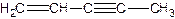 是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;
是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;某化学实验室产生的废液中含有Fe3+、Cu2+、Ba2+、Cl-四种离子,现设计下列方案对废液进行处理,以回收金属并制备氯化钡、氯化铁晶体。

(1)沉淀1中含有的金属单质是 。
(2)氧化时加入H2O2溶液发生反应的离子方程式为 。
(3)下列物质中,可以作为试剂X的是 (填字母)。
A.BaCl2 B.BaCO3
C.NaOH D.Ba(OH)2
(4)检验沉淀2洗涤是否完全的方法是 。
(5)制备氯化铁晶体过程中需保持盐酸过量,其目的是 。
(6)由过滤2得到的滤液制备BaCl2的实验操作依次为 、冷却结晶、 、洗涤、干燥。
某化学实验室产生的废液中含有Fe3+、Cu2+、Ba2+、Cl-四种离子,现设计下列方案对废液进行处理,以回收金属并制备氯化钡、氯化铁晶体。
(1)沉淀1中含有的金属单质是 。
(2)氧化时加入H2O2溶液发生反应的离子方程式为 。
(3)下列物质中,可以作为试剂X的是 (填字母)。
| A.BaCl2 | B.BaCO3 |
| C.NaOH | D.Ba(OH)2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com