化学是一门以实验为基础的自然科学,正确搭配、选择、识别各种实验装置,是基本的化学素养之一.请按要求完成下列四小题.
(1)一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验.某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液.下列有关说法中正确的是
ABD
ABD
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL 的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E.配制溶液时,若在最后一次读数时俯视读数,则导致实验结果偏大.
F.中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大.
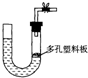
(2)右图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是
B
B
A.大理石和稀硫酸制取二氧化碳
B.锌粒和稀硫酸制氢气
C.浓硫酸和亚硫酸钠制取二氧化硫
D.电石和水制取乙炔
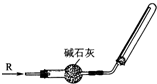
(3)实验室可用右下图所示装置干燥收集某气体R,则R可能是
B
B
A.S0
2 B.NH
3C.NO D.Cl
2(4)某同学如右图所示装置进行实验,出现小气球鼓起来的现象,则使用的固体和液体试剂可能是
C
C
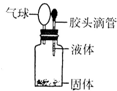
A.铜与浓硫酸 B.铁与浓硫酸
C.铝和氢氧化钠溶液 D.二氧化锰和浓盐酸
(5)指出下面3个实验中各存在的一个错误
滴管口伸入试管中;试管口向上;混合气体从短导管进入洗气瓶.
滴管口伸入试管中;试管口向上;混合气体从短导管进入洗气瓶.
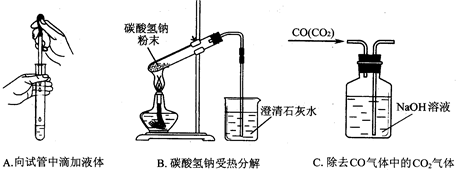
A
滴管口伸入试管中
滴管口伸入试管中
;B
试管口向上
试管口向上
; C
混合气体从短导管进入洗气瓶
混合气体从短导管进入洗气瓶
.





 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况,回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况,回答下列问题: