
题目列表(包括答案和解析)
| 2 |
| 3 |
c(N
| ||
| c(OH-) |
(1)25 ℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g)
△H=-92.4 kJ/mol
2NH3(g)
△H=-92.4 kJ/mol
①在该温度时,取l mol N2和3 mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是_______92.4 kJ。(填“小于”, “大于” 或“等于”)
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是_______________。
A.NH3生成的速率与NH3分解的速率相等
B.混合气体的反应速率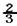 v正(NH3)=v逆(H2)
v正(NH3)=v逆(H2)
C.容器内的密度不再变化
D.单位时间内消耗a mol N2,同时生成2a mol NH3
(2) 25 ℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0 mL,测得PH=11,则该条件下,NH3•H2O的电离平衡常数为__________。向此溶液中加入少量的氯化铵固体,此时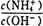 值将_____(填“增大”, “减小” 或“不变”)。
值将_____(填“增大”, “减小” 或“不变”)。
(3)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当PH=_________时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33)
 G.
G. 

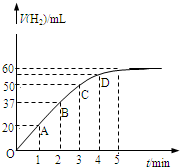 在恒温、恒容的密闭容器中发生如下反应:2HI(g)?H2(g)+I2(g),实验测定,在标准状况下产生氢气的体积和时间的关系如图所示.回答下列问题:
在恒温、恒容的密闭容器中发生如下反应:2HI(g)?H2(g)+I2(g),实验测定,在标准状况下产生氢气的体积和时间的关系如图所示.回答下列问题:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com