
题目列表(包括答案和解析)
|
在给定的四种溶液中,加入下列各种离子,各离子一定能在原溶液中大量共存的是 | |
| [ ] | |
A. |
c(H+)<c(OH-)溶液中:S2- SO32- K+ Na+ |
B. |
含大量Fe3+的溶液中:NH4+ OH- SO42- Br- |
C. |
与Al反应放出H2的溶液中:Mg2+ K+ HCO3- NO3- |
D. |
pH=1的溶液中:Fe2+ NO3- I- Na+ |
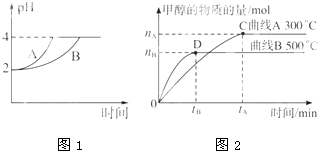
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
| O | 2- 3 |
| |||||||||||||||
| O | 2-3 |
 ,经计算 (填”有”或”无”)Mg(OH)2沉淀生成.
,经计算 (填”有”或”无”)Mg(OH)2沉淀生成. 水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论).
水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论).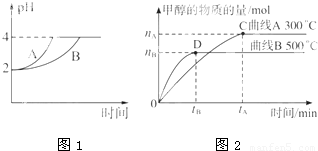
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com